Difteria toxin
| Difteria toxin (Corynephage β) | ||
|---|---|---|
| ||
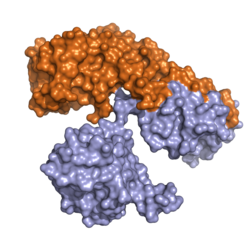
| Felszíni modell a PDB 1DDT szerint . A lánc (enzim) narancssárga, B lánc (transzporter) világoskék. | ||
| Tömeg / hosszúság elsődleges szerkezet | 535 = 193 + 342 aminosav | |
| Másodlagos a kvaterner struktúrához képest | A + B | |
| Azonosító | ||
| Gén neve (i) | DT | |
| Külső azonosítók | ||
| Enzim osztályozás | ||
| EK, kategória | 2.4.2.36. , Glikozil-transzferáz | |
| Válasz típusa | ADP ribózmaradék átvitele | |
| Szubsztrát | NAD + + EF-2 | |
| Termékek | NAD + EF-2 (hibás) | |
A diftéria toxin (DT) egy exotoxint a Corynebacterium diphtheriae , kórokozója a diftéria és gátolja a fehérjeszintézist a eukariótákban és archaea blokkolásával a transzlációs során nyúlás fázisban . A nagy molekulatömegű és hőre labilis toxin az egyik lektin . A genetikai információt a β prophág (" Corynebacterium phage beta ") tartalmazza. Csak akkor képes a toxint termelni, ha a baktérium általa megfertőződött. Így ( toxinfertőzés fágkonverzió útján + - fágok révén ) a nichttoxigene C. diphtheriae képes előállítani, megszerezni a DT törzsek képességét.
Hatásmód
A toxin két fehérjéből áll, az A -toxinból és a B-toxinból , amelyek diszulfid híddal (Cys186-Cys201) kapcsolódnak és szelektíven kötődnek az eukarióta sejtek 80 S-riboszómájához . Tömege körülbelül 61 kDa . Három ismert funkcionális terület ( domén ) van a toxinon:
- R domén: receptorkötő hely és lehetővé teszi a célsejt receptorfehérjéhez való kötődést
- T domén: ez a domén közvetíti a toxin enzimrészének transzlációját a célsejtbe
- C domén: enzimatikus rész, amely katalizálja az ADP ribozilezését (lásd alább)
A C domén az N-terminális A láncon, az R és T domén a B láncon található.
A sejtbe való behatolás ugyanolyan mechanizmusnak van kitéve, mint a ricin esetében : a B-lánc a sejtfelszínen lévő receptorhoz kapcsolódik , és ezáltal a toxint egy 21 kDa A-fragmentumra és egy 40 kDa B-fragmentumra osztja, az A-fragmentum behatolva a sejt. A diftéria toxinnak ez a mechanizmusa megegyezik sok más bakteriális toxinnal, az AB toxinok csoportjába tartozik .
Az A fragmens enzimatikus aktivitásának célja az eEF-2 megnyúlási faktor , amely katalizálja a transzlációt az eukarióták fehérjeszintézisében . Az eEF-2 diftamidot tartalmaz , egy szokatlan aminosavmaradékot a 715 - ös pozícióban, ismeretlen funkcióval, amelyet poszttranszlációs úton képeznek a hisztidinből . A toxin A fragmense katalizálja ennek a diftamidnak a kovalens módosítását. Egy ADP - ribozil maradékot származó NAD + kerül át egy nitrogénatomot tartalmaz a diphthamide gyűrű lehasadása nikotinamid . Az egyik egy ADP riboszilezésről beszél.
A diftamid csak az eEF-2-ben található meg, ami megmagyarázza a magas specifitást. A diftéria toxin ezáltal gátolja az eEF-2 képességét a növekvő polipeptid lánc transzlálására. A fehérjeszintézis leáll, és ez okozza a diftéria toxin figyelemre méltó toxicitását. Csak egy láncmolekula elegendő egy sejt elpusztításához. A szív- és idegsejtekben a felületi receptorok nagy sűrűsége miatt ezek a sejtek a legérzékenyebbek.
A diftéria toxin a diftéria vakcinák hatóanyaga .
A toxin kristályszerkezetét 1992-ben határoztuk meg 2,5 Å felbontással .
CRM 197
A toxin CRM 197 nevű nem toxikus változatát ( keresztreaktív anyag 197 ) használják konjugált vakcinákhoz . Az 52. pozícióban lévő glicin aminosavat glutaminsav helyettesíti , ami azt jelenti, hogy az ADP-ribozil-transzferáz aktivitás elvész. A CRM 197 mutánst először 1973-ban izolálták, az 1980-as évek közepéig tovább optimalizálták és termelés céljából egy baktérium törzsbe klónozták.
Hasonló méreganyagok
A kórokozókból származó egyéb mérgek szintén két egymással összekapcsolt peptidláncból állnak, amelyek közül az egyik a sejtfelszínen lévő receptorhoz kötődik, és így a másik láncnak hozzáférést biztosít a sejt belsejéhez, például kolera-toxint , pertussis-toxint (szamárköhögés-toxint). ) és lépfene toxint . Ezen toxinok toxikus mechanizmusai azonban eltérőek. A Pseudomonas aeruginosa- ból származó exotoxin A ugyanazt a NAD-függő ADP- ribozilezési mechanizmust alkalmazza .
irodalom
- Sticker Lubert: Biokémia . Verlag Spektrum der Wissenschaft, Heidelberg 1990, ISBN 3-89330-690-0 , 791-796.
Egyéni bizonyíték
- ↑ Marlies Höck és Helmut Hahn: Corynebacteria . In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan HE Kaufmann, Thomas F. Schulz (szerk.): Orvosi mikrobiológia és fertőző betegségek . Springer-Verlag, 2016, ISBN 978-3-662-48678-8 , pp. 309 .
- ^ Diphtheria - RKI-Ratgeber. In: RKI. 2018. január 10, elérhető: 2021. február 2 .
- ↑ SIB: vírusos exotoxin . Expasy: ViralZone
- ^ SIB: A gazda virulenciájának modulálása vírussal . Expasy: ViralZone
- ↑ a b c d Michael Bröker és mtsai: A keresztreakcióban levő anyag biokémiai és biológiai jellemzői 197 CRM197, a diftéria toxin nem toxikus mutánsa: felhasználás konjugációs fehérjeként vakcinákban és más lehetséges klinikai alkalmazásokban . In: Biologicals: Journal of the International Association of Biological Standardization . szalag 39 , no. 4. , 2011. július, p. 195-204 , doi : 10.1016 / j.biologicals.2011.05.004 , PMID 21715186 .
- ↑ a b c Marlies Höck és Helmut Hahn: Korynebacteria . In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan HE Kaufmann, Thomas F. Schulz (szerk.): Orvosi mikrobiológia és fertőző betegségek . Springer-Verlag, 2016, ISBN 978-3-662-48678-8 , pp. 311 f .
- ↑ Jeremy M. Berg és mtsai: Stryer Biochemistry . 8. kiadás. Springer-Verlag, 2018, ISBN 978-3-662-54620-8 , pp. 1085 .
- ↑ Seunghyon Choe és mtsai: A diftéria toxin kristályszerkezete . In: Természet . szalag 357 , no. 6375 , 1992. május, pp. 216-222 , doi : 10.1038 / 357216a0 .
- Ric Enrico Malito és mtsai: Strukturális alapok a diftéria toxin mutáns CRM197 toxicitásának hiányára . In: Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiájának közleményei . szalag 109 , no. 2012. április 14. , 14. o. 5229-5234 , doi : 10.1073 / pnas.1201964109 , PMID 22431623 , PMC 3325714 (ingyenes teljes szöveg).

![{\ textstyle {\ ce {NAD + + eEF 2 -> [{A-lánc}] ADP-ribozil-eEF 2 + nikotinamid + H +}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e140666bc4576ae60ef1dcb34155323ae2f23ea7)