Luciferinek

A luciferinek (a latin luciferből származnak , "fényt hoznak" ) különböző természetes anyagok , amelyeket különböző biolumineszcens szervezetekben használnak fény előállítására. A megfelelő luciferáz - enzim katalitikus aktivitásával oxigénnel reagál ( oxidáció ). A változás során, többnyire a luciferin alcsoportjainak szétválasztásakor, az energia fény formájában távozik . Mind a luciferinek, mind a luciferázok faj- vagy taxonspecifikusak , vagyis az élőlények minden csoportjára jellemzőek.
sztori
Robert Boyle már a 17. században megfigyelte, hogy minden biolumineszcens rendszer oxigént igényel.
A 18. század elején René Réaumur megfigyelte, hogy víz hozzáadása után a szárított és őrölt biolumineszcens élőlények porai világítanak. A luciferin-luciferáz rendszerekkel végzett kísérleti munkáról szóló első jelentések a francia Raphael Dubois-hoz nyúlnak vissza . 1885-ben, szentjánosbogarakon dolgozva felfedezte, hogy egy anyagot fénykibocsátó reakcióban fogyasztanak el. Ennek során különböző organizmusokból olyan anyagokat vonott ki, amelyek biológiai fényt termelnek, amelyek az izzás okai és nem pusztulnak el a hő hatására, és ezeket luciferinnek nevezte . Luciferázt hívott , egy másik, a világításhoz szükséges komponenst, amely hőálló . Manapság ismert, hogy a taxon-specifikus luciferáz az az enzim, amely a hozzá tartozó taxon-specifikus luciferint átalakítja. A luciferint luciferázzal oxigén jelenlétében összekeverve Dubois képes volt utánozni a természetes biolumineszcenciát .
A következő vizsgálatokat Edmund Newton Harvey végezte a 20. század elején. Megállapította, hogy minden luciferin-luciferáz rendszerben megvan a sajátosság. Tehát egy faj luciferinjeit nem lehet átalakítani egy másik faj luciferázával. Osamu Shimomura , a Nobel -díjas 1950 -es évektől nagy előrelépést ért el a szerkezet felderítésében .
tulajdonságait
A biolumineszcens rendszerek nem evolúciósan konzerváltak; a luciferázok nem rendelkeznek szekvenciahomológiával . A luciferázok 17 különböző törzsben és legalább 700, főként tengeri nemzetségben fordulnak elő . Nyilván gyakran " feltalálták " őket; a filogenetikai vizsgálatok azt mutatták, hogy a luciferin-luciferáz rendszereknek több mint 30 független eredete van. A kibocsátott színtartomány a kék és a vörös fény között van (400-700 nm), a kék árnyalatok a leggyakoribbak, míg a vörös színek ritkán figyelhetők meg. Ez azzal magyarázható, hogy a legtöbb biolumineszcens élőlény a tengerben található, és a kék fény a legmesszebb hatol a vízbe.
meghatározás
A klasszikus definíció szerint a luciferázhoz kötött luciferin a fénykibocsátó. A luciferáz oxigénfogyasztás közben átalakítja a luciferint; néha ehhez kofaktorok, például ATP vagy ionok is szükségesek. Az oxidált luciferin kezdetben I. átmeneti állapotban van, majd - gyakran dekarboxilezés és további köztes lépések után - elektronikusan gerjesztett P *állapotba kerül. Nagyon rövid idő (néhány nanoszekundum) után ez visszaesik P alapállapotába, és ez idő alatt fénykvantumot bocsát ki . Általában az átalakított luciferinek is fluoroforok , mivel a fény besugárzásával gerjesztett állapotba kerülhetnek.
Alapelvek
Biokémiai szempontból sok energiára van szükség ahhoz, hogy P *gerjesztett állapotba kerüljön. Az 500 nm hullámhosszú (zöld, körülbelül 2 eV / foton energia) fotonok kibocsátásához körülbelül 250 kJ / mol szükséges - összehasonlításképpen: az ATP hidrolízise ADP -vé és foszfáttá körülbelül 30 kJ / mol szabadul fel. Ezenkívül az energia csak egy lépésben szabadítható fel. Az energiát a molekuláris oxigén szolgáltatja, ha annak viszonylag gyenge kettős kötése megszakad, és erősebb kötés jön létre (például CO 2 -ben 300 kJ / mol stabilabb).
A legelterjedtebb elv egy négytagú gyűrű, egy dioxetán vagy dioxetanon (α-peroxilakton) képződése. A dekarboxilezés után létrejön az elektronikusan gerjesztett állapot.
Néha a fluoreszcencia nem felel meg a vártnak, például in vitro vizsgálatokban (kémcsőben). Ennek különböző okai vannak. Például az enzimekhez kötődő luciferinek másképpen bocsátanak ki oxidáció során, mint a szabad luciferinek, amikor fény hatására izgatják őket. Néha az energiát átviszik egy második fluoroforba, mint például az Aequorin esetében a GFP -hez az Aequorea victoria -ban .
Kvantum mező
A kvantumhozam határozza meg, hogy a luciferin megfelelő luciferáz általi átalakítása hatékony -e . A kvantumhozam az átalakított luciferin molekulánként kibocsátott fénykvantumok száma. Az 1 kvantumhozam azt jelentené, hogy a luciferin minden átalakított molekulájához egy könnyű kvantum szabadul fel. Az eddigi legnagyobb Q kvantumhozamot a Photinus pyralis -ból származó szentjánosbogár luciferin esetében mutattuk ki Q = 0,41 értékkel .
Luciferin típusok
A luciferin-luciferáz rendszerek számos típusban kaphatók. A luciferin-luciferáz rendszereknek négy fő osztálya van, amelyekben a luciferin luciferázzal történő átalakítás után elektronikusan gerjesztett állapotba kerül, és így válik a tényleges fénykibocsátóvá.
A szentjánosbogár luciferin, egy benzotiazol
A biolumineszcens rovarok a Collembola , a Hemiptera , a Coleoptera és a Diptera négy rendjében vannak jelen . Azonban csak az utóbbi két rendből származó organizmusok biolumineszcenciáját vizsgálták. A Coleoptera -ban (bogarak) három család képviselői tudnak fényt termelni: Phengodidae ( tollas szentjánosbogarak ), Elateridae ( cserebogarak ) és Lampyridae ( szentjánosbogarak ).
Az amerikai szentjánosbogár Photinus pyralis ( angol szentjánosbogár ) a Lampyridae családba tartozik . Dubois már használta a luciferin luciferázokkal kapcsolatos tanulmányaihoz (lásd fent). A P. pyralis biolumineszcenciás reakciójának első tudományos vizsgálatát 1917 -ben Harvey kezdeményezte. Időközben ezt a luciferin-luciferáz rendszert vizsgálták a legjobban, és az alábbiakban bemutatjuk.
Biolumineszcens reakció

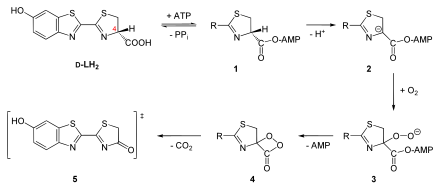
A reakcióhoz a luciferáz oxigénfelhasználással (O 2 ) átalakítja a D- luciferin (LH 2 ) szubsztrátot , egy benzotiazolt . A munka a William D. McElroy a késő 1940-es években azt mutatta, hogy az ATP és a magnézium-ionok szükségesek , mint kofaktorok a reakcióhoz :
Az ATP -t AMP -vé és pirofoszfáttá (PP i ) alakítják át, és fénykvantumot (h ν ) bocsátanak ki.
Összehasonlítva más rendszerek luciferinjeivel (lásd alább), a szentjánosbogarakból származó luciferin viszonylag stabil vegyület. Olvadáspontja 205-210 ° C. Moláris kihalási együtthatója 328 nm -en ε = 18 200 M −1 cm −1 . Ez a luciferin fluoreszkál és emissziós maximumot mutat λ max = 537 nm -nél .
A szentjánosbogár luciferáz ( EC 1.13.12.7 ) molekulatömege körülbelül 60–62 kDa , a P. pyralis -ban pontosan 61 kDa, és 550 aminosavból áll. Katalizálja a luciferin oxidatív dekarboxilezését oxi-luciferinné (oxi-L, lásd még az alábbi ábrát, doboz). A reakció a könnyű szervsejtek peroxiszómáiban megy végbe . A P. pyralis luciferáz szerkezetét 1956 -ban mutatták be először 200 pm felbontással . Ehhez az elemzéshez nagyszámú szentjánosbogarat gyűjtöttek segítőkész gyerekek, akik minden szállított mintáért egy cent jutalmat kaptak.
Kötött szubsztrát nélkül a luciferáz nyitott konformációban van; egy nagy N-terminál és egy kis C-terminális terület mély barázdát képez. Az aljzat megkötésekor a konformáció megváltozása a barázda bezáródásához vezet . A nyolcvanas évek közepén a luciferázt sikeresen beépítették az E. coli baktérium genomjába, és ott fejezték ki . A Lampyridae család szentjánosbogaraiból származó luciferázok szerkezete nagyon hasonló. A különbségek azonban meghatározzák a kibocsátott fény színét. Típustól függően a kibocsátott maximális λ max a kibocsátott fényben 530 nm (zöld) és 635 nm ( piros ) között van.
A reakció a legjobban in vitro 7,8 pH-n és 23-25 ° C hőmérsékleten megy végbe . In vivo , a színe a kibocsátott fény sárga-zöld , hogy sárga (552-582 nm). A laboratóriumban a reakció szélesebb színskálát mutat. Savas környezetben a fény vöröses (615 nm), semleges környezetben zöld-sárga.
Reakciós mechanizmus
A reakció pontos mechanizmusa ismert. A D- luciferint először az ATP adenilezi a karboxicsoportnál , és kilépő csoportként pirofoszfát szabadul fel ( 1 , lásd az ábrát). Ezzel az aktiválással a C4 atom protonja elvonható , karbanion képződik ( 2 ). A luciferin ezután oxigénnel telíthető a C4 atomnál, és lineáris hidroperoxid képződik ( 3 ). Ez dioxetanongyűrűt ( 4 ) képez az AMP eltávolításával . A dekarboxilezés után oxiliuciferin képződik belőle, amely vagy monoanionként ( keto forma , 5 ) vagy dianionként (enol formában) lehet jelen. Mindkét esetben az oxi -luciferin energetikailag gerjesztett állapotban van. Visszaáll az alapállapotba egy foton (piros vagy sárga-zöld fény) felszabadításával. Magát az oxi -luciferint még nem izolálták tiszta formájában, mert rendkívül instabil.
A reakció mechanizmusát a dioxetanon képződésével Shimomura 1970 -es évek végén végzett munkája kétségtelenül bizonyította. A reakcióban izotópjelzett 18 O-t (H 2 18 O vagy 18 O 2 ) használtunk. E munka eredményei felváltották a korábban feltételezett hipotézist, miszerint az oxi -luciferin lineáris kötéshasítással keletkezik. Ha ez valóban megtörténne, a felszabaduló szén -dioxid a vízből származó oxigénatomot tartalmazna. Valójában az oxigénből származik.
Ennek a reakciónak a fényhatékonysága magas, mert a Q kvantumhatékonyság 0,41 8,5 pH mellett.
szintézis

Nem világos, hogy a rovarok - vagy a mikrobiális szimbiionok - hogyan termelik a luciferint. Ismeretes, hogy a D- luciferint a bogár nem szívja fel közvetlenül (kivéve a Photuris nemzetség nőstény bogarait , amelyek a Photinus nemzetség hím szentjánosbogarait eszik).
A szakirodalom két alapvető szintetikus utat tárgyal:
- Az egyik lehetőség a fényreakció után keletkezett oxi -luciferin újrahasznosítása luciferinné. A kulcskomponens az, hogy az oxi-luciferint először 2-ciano-6-hidroxi-benzotiazollá (2C6HB) alakítják át, amit a luciferin-regeneráló enzim (LRE), pl. B. a Photinus pyralis -ban katalizálja. 2C6HB majd kondenzál egy D - cisztein alkotnak D- luciferin. Ezt a kondenzációs reakciót használják a luciferin kémiai szintézisében is (lásd a jobb oldali ábrát). Egy alternatív út a 2C6HB-n keresztül feltételezi, hogy ez kezdetben L- luciferint képez L- cisztein mellett . Ezt követően közbenső lépésekkel racemizálják D- luciferinné (lásd még a bal oldali ábrát).
- A 2C6HB -n keresztüli bioszintetikus útvonalak mindkét lehetősége még mindig problémákat okoz:
- A luciferint regeneráló enzim nem termelődik túl a biolumineszcens bogarak fénytermelő szerveiben. Mivel az oxi -luciferin vizes oldatban instabil, nagy mennyiségű LRE -t kell találni. Ezenkívül a reaktív 2C6HB nemcsak a ciszteinnel, hanem más metabolitokkal is reagálhat. Továbbá nem világos, hogy honnan származik például a D- cisztein, és hogyan lehet különbséget tenni az L- cisztein és a D- cisztein között. Az L- ciszteinből a 2C6HB is reagál az L- luciferinre. Bár ez felveheti a luciferázt szubsztrátként, gátolja a fényreakciót. Ezenkívül még nem sikerült ellenőrizni a racemizációt katalizáló enzimet.
- Az sem világos, hogy a bogarak (vagy szimbiontok) hogyan képesek benzotiazoleneket előállítani.
- A Luciola lateralis japán szentjánosbogár esetében a címkézési kísérletek azt mutatták, hogy a kifejlett bogár hidrokinonból vagy 1,4-benzoquinonból szintetizálja a luciferint . Az L- cisztein kétszer kapcsolódik az 1,4-benzokinonhoz , így képezi a luciferin D vagy L formáját. Az L- D-formává történő racemerizációját még vizsgálják. Mivel az 1,4-benzokinon nagy koncentrációban mérgező, csak röviddel a szintézis előtt szabadul fel. Ebből a célból a tudósok azt sugallják, hogy a glükozid- arbutin hidrokinont biztosít depóvegyületként , amelyet ezután 1,4-benzoquinonná oxidálnak.
Evolúciós eredet

Lehetséges, hogy a szentjánosbogarak luciferin-luciferáz reakciója teljesen más biológiai funkcióból alakult ki. Úgy gondolják, hogy a luciferin molekula későbbi evolúciós eredményben jelent meg, és könnyű reakcióhoz vezetett. Ezt alátámasztja az a tény is, hogy a luciferáz hatékonyan képes kondenzálni az A -koenzimet a luciferin -molekulára, és így betölti a klasszikus zsírsav -CoA -ligáz funkcióját . Ebben az összefüggésben a luciferáz zsírsavakat , például arachidonsavat is használhat , amely hasonló szerkezeti tulajdonságokkal rendelkezik a luciferinnel.
E további katalitikus tulajdonság miatt az eredeti luciferáz egy zsírsav CoA ligáz lehetett. A luciferin megjelenése és a hozzá kapcsolódó fényreakció szelekciós előnyt eredményezett: az adenilezési reakció idővel érvényesült. Ezt a tételt a nem lumineszcens lisztféreg Tenebrio molitor alkalmazásával bizonyítottuk . Ebben nincs luciferin, hanem zsírsav -CoA -ligázok. Érdekes módon könnyű reakció is megfigyelhető ott luciferin hozzáadásával. De anélkül, hogy tudnánk, hogyan bioszintetizálják a szentjánosbogár luciferint, a részletesebb evolúciós elemzés nehéz.
A szekvencia -összehasonlítások arra utalnak, hogy a szentjánosbogarak (Lampyridae) közös őse körülbelül 100 millió évvel ezelőtt, a kréta időszak közepén szintén biolumineszcens volt, és zöld fényt bocsáthat ki. Körülbelül 70 millió évvel ezelőtt a luciferáz gént megkettőzték , és az 1. és 2. típusú luciferázt kapták. Az idők folyamán feladatmegosztás következett: Míg a Luc1 típusú luciferáz felelős a szentjánosbogarak hasán (a fénysejtekben, az úgynevezett "lámpásokban") a lárva, a báb és a felnőtt stádiumban lévő izzásért , a Luc2 lehetővé teszi, hogy a luciferáz típus biolumineszcenciát termeljen a tojásokban és a báb testében. Az akkori utolsó közös ős biolumineszcenciájának célja valószínűleg az aposematizmus egy formája volt , a gén duplikációja után egyes fajok ezt kiterjeszthették a komplex szexuális kommunikáció érdekében (pl . P. pyralis és Luciola parvula). Ez sárgára váltotta az izzást.
Lumineszcencia más rovaroktól

A szentjánosbogár luciferin a másik két család Phenogodidae és Elateroidae lumineszcens rovarában is előfordul. A biolumineszcencia rendszer toll szentjánosbogarak (például Phrixothrix, English phrixothrix ), vagy kattintson bogarak (például a szentjánosbogár Pyrophorus noctilucus ) szinte azonos a a szentjánosbogarak . A tollas szentjánosbogarakban csak a lárvák mutatnak biolumineszcenciát, a felnőttek nem.
Ezzel szemben a lumineszcens Diptera ( Diptera ) ( Arachnocampa vagy Orfelia ) nem közös a szentjánosbogarak luciferinjével. Az Arachnocampa luminosa -ból származó 59 kDa luciferáz ugyanabba a fehérjecsaládba tartozik, mint a szentjánosbogár (31% -os szekvenciaazonosság), de nem képes átalakítani a szentjánosbogár luciferint. Ez a luciferáz-luciferin rendszer a kinolin- szerű luciferint ATP, Mg 2+ és oxigénfüggő reakcióvá alakítja . Az észak -amerikai gombaszúnyog ( Orfelia fultoni ) lárvái által kibocsátott fény a legkékebb (λ max = 460 nm), amelyet rovarok generálnak. Ezek például a Waitomo -barlangokban élnek .
Dehydroluciferin
In vitro kimutatták, hogy az enzimhez kötött, adenilezett D- luciferin ( D- LH 2 · AMP) sötét reakcióban is átalakítható. Ez oxigénnel reagálva hidrogén -peroxidot és dehidroluciferint (L · AMP) képez. Ez utóbbi pirofoszfát segítségével felszabadítható a luciferázból, ezáltal ATP -t termelve.
L · AMP a luciferáz hatékony inhibitora . Nem ismert, hogy a dehidroluciferin képződése fiziológiai körülmények között is megtörténik -e. Legalább a keletkező hidrogén -peroxid (H 2 O 2 ) a peroxiszómákban gyorsan detoxikálható.
Tetrapirrol, a dinoflagellates és az Euphausiidae luciferinje
- Dinoflagellate biolumineszcencia, amelyet a hullámok megtörése okoz
Strand Manasquan közelében ( New Jersey , USA)
A kép Carlsbad közelében (Kalifornia, USA) készült
A kép a Seal Beach -en készült (Kalifornia, USA)
Az ebbe a csoportba tartozó luciferin megfelel egy lineáris, nyitott tetrapirrol kémiai szerkezetének, és megtalálható többek között a dinoflagellate -ekben ( Noctiluca , Gonyaulax , Pyrocystis ). A tengeri fények , amelyeket korábban tévesen foszforeszcenciának neveztek , nagyrészt ezekre az egysejtű algákra vezethetők vissza. A luciferin-luciferáz rendszer vizsgálata az 1950-es évek végén kezdődött a Lingulodinium polyedra dinoflagellate- n (szinonima: Gonyaulax polyedra ) J. Woodland Hastings és munkatársai munkájával. A Pyrocystis nemzetséget most a dinoflagellates biolumineszcencia kutatásának modellszervezetének tekintik.
A fénykibocsátás a luciferin mellett van, és ennek megfelelő, körülbelül 135 kDa-os luciferáz (LCF) szükséges, gyakran úgynevezett luciferin-kötő fehérje ( angol luciferin-kötő fehérje , LBP). Az LBD egy homodimer , egy alegysége 72 kDa. Ebben a családban a luciferin rendkívül instabil alacsony pH -értékek (<pH 4), magas só és még alacsony oxigénkoncentráció esetén is. Kimutatható, hogy az LBD a dinoflagellate luciferinhez kötődik 8,0 pH -n, de nem 6,3 pH -n. Ennek célja a szubsztrát védelme, amíg a reakció be nem következik, ami az L. polyedra -ban 6,3 pH -n működik a legjobban, különösen azért, mert a luciferáz inaktív enyhén lúgos környezetben (pH 8,0). A luciferin oxigénnel történő átalakításához azt javasolták, hogy ez több köztes szakaszon keresztül történjen gyökökön keresztül. Maga a reakció speciális organellákban , az úgynevezett szcintillonokban játszódik le . Ezek átlagosan 0,4 µM méretűek, és főleg luciferázokat, luciferineket és (fajtól függően) LBP -ket tartalmaznak. A szcintillonokat az éjszaka folyamán átviszik a sejt perifériájára. A reakció során keletkező fény kékeszöldesnek tűnik (gerjesztési maximum λ max = 390 nm, emissziós maximum kb. Λ max = 480 nm). A konvertálandó luciferin enzimhez kötött köztiterméke szolgál fénykibocsátóként. Teljes aktiválás esetén a P. lunula körülbelül 4 milliárd fotont bocsáthat ki éjszaka.

Egyelőre nem tisztázott, hogy a luciferin a klorofill a -ból származik -e a klorofill a -hoz (fotooxidatív bomlástermék) való kapcsolata miatt, vagy először fokozatosan kell felépülnie több aminosavból ( glicinből és glutaminsavból ). Az a tény, hogy például a L. polyedra esetében a luciferin csak éjszaka áll rendelkezésre, így a napfény által történő oxidatív lebomlás nem lehetséges. Az is paradox, hogy a fényreakcióban keletkező oxi-luciferin nem fluorofór.
F komponens krillben
Majdnem azonos szerkezetű luciferint is találtak a lumineszcens Euphausiidae -ban ( krill ), pl. B. Meganyctiphanes norvegica vagy Euphausia pacifica . Ott F komponensnek nevezik , amelyet táplálékkal fogyasztanak be. A reakció mechanizmusa megegyezik a dinoflagellátok reakciójával.
Flavin, bakteriális luciferin
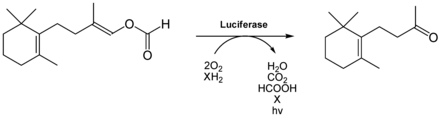
A lumineszcens baktériumok csökkentett flavin-mononukleotidot (FMNH 2 , amely riboflavin-5-foszfát néven is ismert) használnak fénykibocsátó reakcióhoz. Előfordulnak vagy - ritkábban - földfelszíni ( Vibrio , Xenorhabdus , Photorhabdus ) vagy szabadon élő tengerre ( Beneckea , Vibrio ) vagy szimbiotikus vagy parazita vagy más állatokat. Felelősek sok izzó mélytengeri hal biolumineszcenciájáért, ahol szimbiontként tartják őket speciális világítószervekben ( fotobaktérium ). Elvégre biolumineszcens baktériumok is megtalálhatók a tápanyag -körforgásban: az óceán középső mélyén tapadnak a széklethez, amely e baktériumok biolumineszcenciáján keresztül vonzza a halakat. Lenyelés után jobb feltételeket találnak a túléléshez a halbélben. Az eddig azonosított biolumineszcens baktériumok mind Gram- negatívak, rúd alakúak, mobilok és fakultatív anaerobok. Egy jól ismert, biolumineszcens tulajdonságú baktérium például az Aliivibrio fischeri . Foszforeszkáló baktériumot azonosítottak a családok Vibrionaceae , Shewanellaceae és Enterobacteriaceae , és az nemzetségek Vibrio , Photobacte , Aliivibrio , Photorhabdus és Shewanella .
A bakteriális biolumineszcencia vizsgálata az 1950 -es években különleges előrelépéshez vezetett. A kutatók, Milton J. Cormier és Bernard L. Strehler rájöttek, hogy a biolumineszcens reakcióhoz négy tényező szükséges: Az FMNH 2 mellett luciferázra, molekuláris oxigénre és telített szénhidrogén hosszú láncú aldehidre van szükség. Az aldehidet, a hexadecanalt kémiai azonosítása előtt „ vesekéreg -faktornak ” nevezték, mivel az aldehidet a sertések mellékvesekéregéből izolálták. A fényreakcióhoz más aldehidek is használhatók, például dekanál vagy dodecanal . A következő táblázat 40 g izolált baktérium összetételét mutatja be. Feltételezzük, hogy főként tetradekanált alkalmaznak.
| aldehid | P. phosphoreum | A. fischeri |
|---|---|---|
| 10C atomok ( dekanál ) | <1 nmol | <1 nmol |
| 11C atomok | <1 nmol | <1 nmol |
| 12C atomok ( dodekanál ) | 30 nmol | 32 nmol |
| 13C atomok | 6 nmol | 2 nmol |
| 14C atomok ( tetradekanál ) | 380 nmol | 29 nmol |
| 15C atomok | 6 nmol | 6 nmol |
| 16C atomok ( hexadecanal ) | 180 nmol | 18 nmol |
| 17C atomok | <1 nmol | 2 nmol |
| 18C atomok | <1 nmol | <1 nmol |
Az FMNH 2 és az aldehid az oxigéntől függően FMN -vé és karbonsavvá alakul át (lásd még az ábrát):
Ezt a reakciót egy bakteriális luciferáz, egy flavin-függő monooxigenáz katalizálja . Mivel ez egyidejűleg az aldehidet karbonsavvá oxidálja, ez egy vegyes funkciójú oxidáz. Valamennyi lumineszcens baktériumban a luciferáz 76 ± 4 kDa méretű heterodimer . Ez egy α és β fehérje alegységből áll (40–42 kDa, illetve 37–39 kDa), amelyek szétválasztása alig mutat aktivitást. A katalitikus centrum valószínűleg az α-alegységben található. A β-alegység feltehetően szükséges a stabilitáshoz, a szerkezethez és a kvantumhozamhoz. A luciferáz 6,0-8,5 ( Photobacterium phosphorerum , A. fischeri ) vagy 6,0-9,5 ( Benecka harveyi ) pH -értéken aktív , de nem 30-35 ° C feletti hőmérsékleten. A Vibrio harveyi luciferáz kristályszerkezetét 150 pm felbontással oldottuk meg .
Az FMNH 2 szabad oldatban instabil és könnyen oxidálódik. Enzimekhez kötődve azonban stabilitása növekszik, és nukleofil módon megtámadja az oxigén a C4a pozícióban . Ez 4a hidroperoxidot hoz létre , amely szokatlanul stabil. Ez az aldehiddel reagálva peroxihemiacetált képez, amely végül zsírsavvá és 4a-hidroxiflavinná bomlik. Ez utóbbi izgatott állapotban van, és fénykibocsátásakor visszatér alapállapotába. Ez azt jelenti, hogy a 4a-hidroxiflavin a tényleges fénykibocsátó. Alapállapotban ez FMN -ként hidrolizálódik.
A luciferáz által katalizált reakcióban kékeszöld fény sugárzik, amelynek in vitro emissziós maximuma kb. Λ max = 490 nm. In vivo azonban 472-545 nm hullámhossz -maximumokat figyeltek meg. Ennek oka a gerjesztési energia FRET -en keresztül történő átvitele a fluoreszkáló fehérjékbe . A fluoreszkáló fehérjék két osztályát azonosították: kék fluoreszcens lumazinfehérjék (LumPs), lumazinnal kromofórként ( P. phosphoreum , A. fischeri ). Alternatívaként a sárga fluoreszkáló fehérjék (YFP-k) alkotják a második osztályt, amelyek kromofórja FMN vagy riboflavin ( A. fischeri Y-1 törzs). A LumP-k esetében az emissziós maximum 490 nm-ről 476 nm-re tolódik el, YFP-k esetén 484 nm-ről 534 nm-re.A FRET szerinti energiaátvitelhez a luciferin-luciferáz komplexet a megfelelő fluoreszkáló fehérjékhez kell kötni. A kvantumhozam 0,10-0,16.
A FMNH 2 A biolumineszcencia reakciót nem kapunk a riboflavin ( B2-vitamin ) egy riboflavint kináz a ATP-fogyasztást . A reakció után azonban az FMNH 2 regenerálódik az FMN -ből , amely egy flavin -reduktázt katalizál NAD (P) H fogyasztással. Mivel a baktériumsejtben előforduló aldehidek mennyisége (lásd a fenti táblázatot) csak nagyon rövid biolumineszcenciához elegendő, az aldehidek folyamatosan regenerálódnak. A hosszú láncú aldehidet a reakció során keletkező zsírsavakból nyerik ki, amelyet az úgynevezett zsírsavreduktáz komplexben katalizálnak ATP és NAD (P) H fogyasztásával.
A biolumineszcens reakció sok energiát emészt fel, mivel két NAD (P) H molekula és egy molekula ATP szükséges a komponensek regenerálásához. Ennek eredményeként ezt a fényreakciót megfelelően szabályozni kell. Ezenkívül a flavin -reduktázok forgalma magasabb, mint a luciferázé. Túl sok FMNH 2 keletkezik, ha a tevékenység ellenőrizetlen . Gyors oxidációja (lásd fent) ezért sok NAD (P) H -t pazarolna. Ez hangsúlyozza a szabályozás szükségességét.
Lux gének
Minden fehérjét, amelynek köze van a biolumineszcens reakcióhoz, úgynevezett lux gének (lat. Lux light) kódolják . A luciferáz alegységeit a luxA és luxB gének kódolják, a luxB gént valószínűleg a luxA génből való gén duplikációval hozzák létre (30% -os szekvenciaazonosság). A LuxA -t és a LuxB -t már sikeresen klónoztuk markerként . Lux C, D és E kód a zsírsav- reduktáz komplexre , itt lux C egy NADPH-függő acilfehérje-reduktázra (kb. 54 kDa), lux D egy acil-transzferázra (kb. 33 kDa) és lux E egy acilfehérje-szintetázra (kb. 42 kDa).
A lux gének egy operonon helyezkednek el , amelyet egyetlen promoter szabályoz. A gének ( luxCDABE ) elrendezése a biolumineszcens baktériumok között megmarad. Ezenkívül néhány biolumineszcens baktériumnak van egy másik génje a lux operonon, a luxG , amely flavin -reduktázt kódol . Más géneket azonosítottak a lux operonban vagy a szomszédos operonban ( luxR ), mint pl B. luxF, ribEBHA vagy luxI .
Az A. fischerii -ből származó lux géneket in vitro kísérletekhez használjuk .
A koelenterazin, számos tengeri biolumineszcens szervezet közös kémiai összetevője

A luciferin -koelenterazint Milton J. Cormier Renilla reniformis és Frank H. Johnson tengeri tollfajokkal végzett munkája révén fedezték fel az A. victoria medúzákon . Ez nagyon széles körben elterjedt bioluminescent tengeri élőlények, például képviselői közül a csalánozók ( Cnidaria ), borda medúza ( bordásmedúzák ), puhatestűek ( Molusca ), ízeltlábúak ( Arthropoda ) és gerinchúrosakról ( Chordata ). A coelenteratzint nem fedezték fel a szárazföldi élőlényekben vagy az anelidákban ( Annelida ). Néha ők is megtalálható kis mennyiségben nem foszforeszkáló szervezetek, mint például a tűz szivacs Microcina burjánzásának . Ez sem tartalmaz luciferázt.
A koelenterazin aminopirazin alapszerkezettel rendelkezik, és fénykibocsátó komponensként van jelen, mint jóhiszemű luciferin. Gyakran kromofórként is kötődik a fotoproteinekhez, mint pl B. Aequorin , Obelin vagy Symplectin . A koelenterazin -származékokat számos tengeri élőlény is használja.
A módosítatlan koelenterazin alig stabil semleges vizes oldatokban, ahol a légköri oxigén könnyen oxidálja. Stabilabb metanolban. Ott sárgásan fluoreszkál ( ε = 9800 M −1 · cm −1 , λ max = 435 nm). Általában a coelenterazinok oxigénnel reagálva coelenteramidokat képeznek. Dekarboxilezés következik be, és egy koelenteramid anionja keletkezik. Ez a fénykibocsátó is, így általában kék fényt bocsátanak ki. Ez a reakció biokatalizálható (biolumineszcencia), de spontán is lejátszódhat ( kemilumineszcencia ). A biolumineszcens reakciót a következő bekezdés magyarázza.
gépezet
1962 -ben az Aequorea victoria -ból izolálták a fotoprotein aequorint, és 1974 -ben a coelenterazint azonosították luciferinként. 2000-ben mutatták be, hogyan zajlanak a luciferin-luciferáz rendszer biokémiai mechanizmusai az imidazol-pryazinokkal az A. victoria segítségével . Aequorin itt alapvető szerepet játszik. Az Aequorin egy kicsi fotoprotein, és a képernyő szélén található a medúzákban. Az Aequorin esetében a luciferin ( koelenterazin ) már peroxidhíddal kapcsolódik a fehérje részhez. Ennek eredményeként a fotoprotein már magában hordozza az O 2 oxidálószert . Enzimhez kötött formában a koelenterazin hosszabb ideig is tárolható. Az Aequorinnak három kötőhelye van a kalciumionokhoz. Amikor kalciumionok kötődnek hozzá, a fehérje konformációja úgy változik, hogy intramolekuláris reakció lép fel a koelenterazinnal. Ez kezdetben reakcióba lép, és instabil dioxetanongyűrűt képez, így a CO 2 felosztása után végül a koelenteramid anionja képződik. Az alapállapotba való ellazítás után fénykvantumot bocsátanak ki , amelynek hullámhossza λ max = 465 nm. Ennek a kék fénynek köszönhetően a fehérjét kék fluoreszcens fehérjének (BFP) is nevezik . A fotoprotein végül regenerálódik koelenterazin és molekuláris oxigén jelenlétében.
Az Aequorea victoria nem kéken, hanem zölden fluoreszkál. A kék fluoreszkáló fehérje ugyanis sugárzás nélkül továbbítja a biolumineszcens reakció energiáját az úgynevezett zöld fluoreszcens fehérjére ( GFP ).
Watasenia luciferin
A biolumineszcens mélytengeri polip Watasenia scintillans- t először 1905-ben írták le (akkor még Abraliopsis scintillans néven ). Testén számos fényforrás található, amelyek kékes színben ragyognak, mint a csillagos ég. A biolumineszcens reakcióhoz módosított koelenterazin szükséges. Ez a koelenterazin diszulfátja, és 1976 -ban izolálták a tintahal májából. Watasenia luciferin néven ismert. Semleges vizes oldatokban instabil és hajlamos az auto-oxidációra ( kemilumineszcencia ), amelyet különösen a hidrogén-peroxid és a vas (II) -ionok indukálnak. A luciferin vizes oldatokban erősen fluoreszkáló (λ max = 400 nm).
A Watasenia luciferint egy még nem izolált, membránhoz kötött luciferáz alakítja át, amelynek eredményeképpen kék fény bocsát ki (λ max = 470 nm). A reakció optimális pH -ja 8,8 és optimális hőmérséklete 5 ° C, és a molekuláris oxigén mellett ATP -t és Mg 2+ -t igényel . A kvantumhozam 0,36. A reakciómechanizmushoz azt javasolták, hogy a luciferint ATP -vel adenilezzük, így képes kötődni a luciferázhoz. A reakció további folyamata magában foglalja a dioxetanongyűrű és végül a koelenteramid -anion képződését, amint azt a fentiekben általában bemutattuk. Ez 400 és 580 nm közötti fényt hoz létre (λ max = 470 nm).
Vargula luciferin
A kagyló rákok fajok Vargula hilgendorfii (más néven Cypridina hilgendorfii 1962-ig ) kiüríteni lumineszcens folyadék tengervíz, ha fenyegetve érzik magukat. Az ezekben a kagylókban található luciferáz-luciferin rendszer biokémiai vizsgálatait Harvey kezdeményezte a 20. század elején. Most alaposan megvizsgálták.
A luciferint, a vargulint 1957 -ben izolálták, és 1966 -ban imidazol -pryazin komponensként azonosították. Vízben, metanolban és alkoholos oldószerekben oldódik. A Vargulin sárga színű a semleges oldatokban, és abszorpciós maximumot mutat metanolban λ max = 432 nm -en, mólarányos extinkciós együtthatóval ε = 9000 M -1 cm -1 . Vizes oldatokban is enyhén fluoreszkáló (gerjesztési maximum λ max = 540 nm -nél ). A vargin nagyon instabil, és különösen a légköri oxigén, de az ólom (IV) oxid is oxidálja . Fény is kibocsátható, így itt kemilumineszcens reakció lép fel - különösen szerves oldószerekben, például diglimben .
A kagylókban a vargulin luciferázzá alakul át koelenteramiddá, oxi -luciferinné, és kék fény szabadul fel ( λ max = 463 nm). A luciferáz 60-70 kDa monomer, 555 aminosavval. Magas a cisztein tartalma és savas fehérje ( izoelektromos pont 4,35).
A biolumineszcens reakció során a vargulin a luciferázhoz kötődik, és oxigénnel telíti a C2 -atomot. Ez egy peroxid -aniont hoz létre, amely ciklizálva dioxetanongyűrűt képez. Ez a dekarboxiláció spontán módon létrejön, és a koelenteramid anionját képezi, amely gerjesztett állapotban van. Miután fénykvantumot bocsátottak ki, visszaáll alapállapotába, és oxi -luciferin szabadul fel. A reakció fénykibocsátója a luciferázhoz kötött oxi -luciferin. A kvantumhozam hőmérséklet- és pH -függő, és Q = 0,30. Etioluciferin is keletkezik 10-15%-os mellékreakcióként, de nem bocsát ki fényt.
Már 1966-ban azt feltételezték, hogy ez a luciferin áll L - arginin , L - izoleucin és L - triptofán . Erre most egyre több jelzés mutatkozik.
Dehydrocoelenterazine ( Symplectoteuthis oualaniensis)
A Symplectoteuthis oualaniensis (japán neve Tobi-ika ) egypolip, amely elterjedta Csendes-óceánon és az Indiai-óceánon . A biolumineszcencia első tanulmányát 1981 -ben publikálták. A tintahal a dehidrokolenterazint egy speciális fotoprotein segítségével alakítja át, amelyet " szimplektinnek "neveznek. Más fotoproteinekhez (aequorin, obelin) hasonlóan, ott is jelen van, mint egy cisztein révén kovalensen kötött kromofor. Az átalakítás során kibocsátott fény kékes; különböző emissziós maximumokat λ max adtak meg (456 nm, 470 nm, 480 nm). A megkötött dehidrocoelenterazint C2 helyzetben oxigénnel ellátják; a biolumineszcenciás reakció után koelenteramid és apo „symplectin” képződik. Utóbbit egy dehidrokolenterazin -molekula „szimplektinné” regenerálja.
A közeli rokon kalmár Symplectoteuthis luminosa (japán neve Suji-ika ) szintén biolumineszcenciát mutat. Az érintett kémiai komponensek és a biolumineszcenciás reakció mechanizmusa hasonló a S. oualaniensiséhez . Nagy mennyiségű dehidrokolenterazint lehet izolálni a tintahal májából.
Biolumineszcens gomba

Mivel az ókorban is bioluminescent gomba ismeretes, amelynek termőtestek egy állandó izzás. A biolumineszcencia 1959 -ben keletkezett a Collybia velutipes és az Armillaria mellea gombák micéliumában, hideg és főtt kivonatok NADPH hozzáadásával történő kombinálásával.
2015 -ben a hispidint luciferin prekurzorként azonosították a Pholiota squarrosa gombában . Ezt egy oldható NADP (H) -függő hidroxiláz alakítja át luciferin-3-hidroxi-hiszpirin (( E ) -6- (3,4-dihidroxi-tiril) -3,4-dihidroxi-2H-pirán-2-on), folyamat O 2 és NADP (H) fogyasztása. Az így képződött luciferint a luciferáz oxidálja oxigénnel, amely látható fényt bocsát ki. A mögöttes luciferin izolálása nehéz instabilitás miatt. A képződött oxi-luciferin a koffeinsav származéka , amely a piruvát hidrolitikus hasítása után koffeinsavvá alakul, és kiindulási anyagként szolgál a hispidin szintéziséhez.
Az Agaricales rend legalább 100 gombafaja ugyanazt a biokémiai reakciót használja fény előállítására. Ökológiai jelentősége még nem ismert, feltehetően a fény vonzza a rovarokat, amelyek aztán elterjesztik a gombaspórákat.
Egy biolumineszcens gomba génjeinek növényi genomokba történő behelyezésével génszerkesztés révén a növényeket függetlenül és tartósan ragyogóbbá lehet tenni, mint valaha, bakteriális génekkel és nanorészecskékkel végzett kísérletek során.
Nem klasszikus luciferin-luciferáz rendszerek
A Latia Luciferin
Az új -zélandi édesvízi csigában ( Latia neritoides ) található luciferin egy terpenoid aldehid, és Latia luciferin néven ismert. A luciferin erősen hidrofób , zsírban oldódó és színtelen folyadék. Abszorpciós maximuma λ max = 207 nm, a moláris extinkciós együttható 13.700 M −1 . Mivel instabil, spontán módon hidrolizálhat hangyasavvá és aldehiddé. Ez utóbbi azonban nem aktív a biolumineszcens reakcióban. Ha az enol-formil-csoportot enol-éter-csoporttal helyettesítik, a luciferin szintén nem aktív.
A latia luciferin katalitikusan átalakul ketonná ( oxi- luciferin), amelyet egy 173 kDa-os, színtelen és nem fluoreszkáló luciferáz katalizál ( EC 1.14.99.21 ). Ez egy homohexamer, az egyes alegységek kb. 30 kDa méretűek.
A luciferin, a luciferáz és az oxigén mellett kofaktor is szükséges a reakcióhoz, a 39 kDa lila fehérje . Ez vörös fluoreszkáló, és úgy tűnik, hogy egyfajta aktivátor a biolumineszcens reakcióhoz. Ehhez azonban nem feltétlenül szükséges, mivel helyettesíthető például aszkorbáttal és NADH -val. A biolumineszcens reakció a lila színű fehérje nélkül is lejátszódhat. A reakció oxidált luciferin molekulát és két hangyasavmolekulát hoz létre egy luciferin, oxigén és víz molekulából:
Ez fényt bocsát ki, amelynek emissziós maximuma λ max = 536 nm. Ezért e csiga nyálkája, amelyet z. B. mechanikus ingerek után kiválasztódik, világoszöld. Ennek a biolumineszcens reakciónak a reakcióhatékonysága nagyon alacsony, mivel a Q kvantumhozam kb. 0,003 (25 ° C) vagy 0,0068 (8 ° C). A kvantumhozam növelése érdekében NADH -t (0,25 mM) és aszkorbátot (1 mM) adhatunk a reakcióhoz úgy, hogy az 0,009 -re (25 ° C) emelkedjen. Ez azonban más reakciótermékeket hoz létre, amelyeket a következő egyenlet képvisel:
Arról, hogy dioxetángyűrű képződik -e közbenső termékként a reakciókban, még vita folyik. A szentjánosbogár oxi-luciferinnel ellentétben a kapott oxi-luciferin nem fluorofór. Feltételezzük, hogy a reakció során felszabaduló energia a tényleges kibocsátóba, egy fehérjéhez kötött flavinba vagy egy flavinszerű csoportba kerül.
Luciferin a Diplocardia longa -ból
A Diplocardia longa féreg luciferinje egy egyszerű aldehid, N- izovaleril-3-amino-propanál. Ez poláris oldószerekben ( metanol , etanol , aceton , metil-acetát ) oldódik , de nem poláris oldószerekben, például hexánban vagy szén-tetrakloridban nem . A biolumineszcens reakció különlegessége, hogy a molekuláris oxigén helyett hidrogén -peroxidra van szükség. A megfelelő luciferáz, egy körülbelül 300 kD -os, erősen aszimmetrikus enzim, majd átalakítja az aktivált formát, egy peroxid -adduktot. A luciferáznak valószínűleg rézre van szüksége, kék-zöld fényt bocsát ki (λ max = 507 nm). Azt azonban nem lehet tudni, hogy a biolumineszcencia milyen célokat szolgálhat általában a férgekben. Itt is meg kell határozni a biolumineszcens reakció tényleges kibocsátóját.
Ennek a reakciónak a kvantumhozama nagyon alacsony, Q = 0,002.

Luciferin a Fridericia heliotából
A szibériai , a kis sörte Fridericia heliota , egy kis (15 mm hosszú, 0,5 mm széles, 2 mg nehéz) fehér-sárgás látszó földigiliszta, egy kék biolumineszcencia fedezték fel (λ max = 478 nm). Ez érintkezés vagy mechanikus irritáció után következik be az epidermisz sejtjeinek területén. A luciferin-luciferáz rendszer egyedülálló, nem reagál más ismert rendszerrel. Az oxigén mellett ATP és Mg 2+ szükséges a reakcióhoz .
A biolumineszcens reakció során a lizinmaradékot oxidatív módon dekarboxilezik. A válasz valószínűleg hasonló lesz a szentjánosbogár luciferinéhez. Kezdeti reakcióként az ATP kötődik a lizinmaradékhoz, majd dioxetanongyűrű.
Alkalmazások
Diagnózis
A szentjánosbogarakból származó luciferin-luciferáz rendszer segítségével gyorsan ellenőrizhető az ATP jelenléte a mintákban. Ezt használják például az élelmiszeriparban a bakteriális szennyeződés kimutatására. Az ATP csak élő szervezetekben fordul elő, amelyek biolumineszcenciás reakcióval kimutathatók az élelmiszerekben.
Mivel Aequorin fényreakciója kalciumionoktól függ, ez a rendszer képes mérni a kalciumionok koncentrációját. Az első alkalmazás 1967 -ből származik, amikor az izomsejtek kalciumkoncentrációjának intracelluláris változásait észlelték az aquorinok segítségével. Az aequorin baktériumokba történő klónozása után meg lehetett mérni a bakteriális citoszol kalciumkoncentrációját. Az eukarióta sejtekben az aquorin klónozása is lehetséges. A transzgenikus növényekben például meg lehetett mérni a citoszolos kalciumkoncentráció változását a növény érintése vagy hideg sokk után.
Géntechnológia / biotechnológia
A luciferázokat gyakran használják markerként a molekuláris biológiában : Azok a szervezetek, amelyek megkapták a gént és beépítették azt a genomjukba, felvillannak, amikor luciferint kapnak . Ily módon kimutatható, hogy valóban kifejeződnek -e azok a gének, amelyeket be szeretnénk juttatni az organizmusokba. Ehhez az expresszálandó gént egy luciferázt kódoló génhez kötik. Egy ilyen riportergén a promóter régiók azonosítására is használható a genomban. A Photinus pyralis és a Renilla reniformis luciferáz génjeit többnyire kereskedelmi forgalomban használják . Mindkét enzimet gyakran használják ugyanazon megközelítésben ( kettős luciferáz vizsgálat ).
A fényreakció felhasználható a fehérje-fehérje kölcsönhatások , a jelátviteli folyamatok során fellépő jelek és a sejtreceptorok aktivitásának mérésére is .
A luciferáz riporterek használatát az élő állatmodell szervezetekre is megállapították ( biokép ). A rákkutatás területén markerrel nyomon lehet követni a daganatok növekedését vagy áttétek kialakulását . Ezenkívül a fehérje expressziója vizualizálható élő állatokban luciferáz-luciferin rendszerekkel.
Lásd még
irodalom
- Osamu Shimomura : Biolumineszcencia: Kémiai elvek és módszerek. Word Scientific Publishing Company, 2006, ISBN 981-256-801-8 .
- T. Wilson, JW Hastings: Biolumineszcencia. In: Annu. Rev. Cell Dev. , 14, 1998, 197-230. PMID 9891783 .
- LF Greer, AA Szalay: A fénykibocsátás képzése a luciferázok expressziójából élő sejtekben és szervezetekben: áttekintés. In: Luminescence , 17, 2002, 43-74. PMID 11816060 ; doi: 10.1002 / bio.676 .
- K. Teranishi: Imidazo [1,2- a ] pirazin-3 (7H) -on vegyületek lumineszcenciája . In: Bioorg Chem. , 35 (1), 2007, 82-111. PMID 17007903 .
- Thérèse Wilson, J. Woodland Hastings: Bioluminescence: Living Lights, Lights for Living . Harvard University Press, 2013, ISBN 978-0-674-06716-5 .
- Aleksandra S. Tsarkova, Zinaida M. Kaskova, Ilia V. Yampolsky: A Tale Of Two Luciferins: Fungal and Earthworm New Bioluminescent Systems . In: A vegyi kutatások beszámolói . szalag 49 , nem. 11. november 2016, p. 2372-2380 , doi : 10.1021 / acs.accounts.6b00322 .
web Linkek
- Luciferin-Luciferáz rendszerek. (Angol)
- Dieter Weiß: Lumineszcencia - Kemilumineszcencia - Biolumineszcencia. Jénai Egyetem
-
Áttekintő oldal. Fotobiológiai Társaság
- Bruce R. Branchini: A Firefly biolumineszcenciájának kémiája.
- J. Woodland Hastings, Wayne Schultz, d Liyun Liu: Dinoflagellate Bioluminescence.
- Leo Yen-Cheng Lin, Edward A. Meighen: Bakteriális biolumineszcencia.
- Vadim R. Viviani: Földi biolumineszcencia.
Egyéni bizonyíték
- ^ Karl Ernst Georges : Átfogó latin-német tömör szótár . 8., továbbfejlesztett és továbbfejlesztett kiadás. Hahnsche Buchhandlung, Hannover 1918 ( zeno.org [hozzáférés: 2019. szeptember 24.]).
- ↑ Waldemar Adam: Biológiai fény . In: Kémia korunkban . szalag 7 , nem. 6 , 1973, p. 182-192 , doi : 10.1002 / ciuz.19730070605 .
- ↑ HU Harvey : Biolumineszcencia . Akadémiai, New York 1952.
- ^ JW Hastings: Biolumineszcencia . In: N. Sperelakis (szerk.): Cell Physiology , 3. kiadás, Academic Press, New York 2001, 1115-1131.
- ^ PJ Herring: A biolumineszcencia szisztematikus eloszlása élő szervezetekben. In: J Biolumin Chemilumin. 1. kötet, 3. szám, 1987, 147-163. O., PMID 3503524 .
- ↑ a b c d e f g h i j k Eveline Brodl, Andreas Winkler, Peter Macheroux: Molecular Mechanisms of Bacterial Bioluminescence . In: Computational and Structural Biotechnology Journal . szalag 16. , 2018. november 15., ISSN 2001-0370 , p. 551-564 , doi : 10.1016 / j.csbj.2018.11.003 , PMID 30546856 , PMC 6279958 (ingyenes teljes szöveg).
- ^ K. Schmidt-Rohr: Az oxigén a nagy energiájú molekula, amely összetett többsejtű életet táplál: Alapvető korrekciók a hagyományos bioenergetikában . In: ACS Omega , 5. kötet, 5. szám, 2020. január, 2221-2233. O., Doi: 10.1021 / acsomega.9b03352 .
- ^ Emil H. White, Eliezer Rapaport, Howard H. Seliger, Thomas A. Hopkins: A szentjánosbogár luciferin kemi- és biolumineszcenciája: elektronikusan gerjesztett állapotok hatékony kémiai előállítása. In: Bioorg. Chem. , Vol. 1, 1-2. Szám, 1971. szeptember, 92-122. O., Doi: 10.1016 / 0045-2068 (71) 90009-5 .
- ↑ a b c d Osamu Shimomura : Biolumineszcencia: kémiai alapelvek és módszerek. Word Scientific Publishing Company, 2006, 1ff, ISBN 981-256-801-8 .
- ↑ D- luciferin külső azonosítói vagy adatbázis-hivatkozásai : CAS-szám:2591-17-5 , EK-szám: 219-981-3 , ECHA InfoCard : 100.018.166 , PubChem : 5484207 , ChemSpider : 4588411 , Wikidata : Q3265801 .
- ↑ GA Keller, S. Gould, M. Deluca, S. Subramani: A Firefly luciferáz az emlőssejtek peroxiszómáit célozza meg. In: Proc Natl Acad Sci USA , 84. kötet, 10. szám, 1987. május, 3264-3268. Oldal, doi : 10.1073 / pnas.84.10.3264 .
- ↑ H. Fraga: Firefly luminescence: történelmi perspektíva és újabb fejlemények. In: Photochem Photobiol Sci , 7. kötet, 2. szám, 2008, 146-158. O., Doi: 10.1039 / b719181b .
- ^ A b John C. Day, Laurence C. Tisi, Mark J. Bailey: A bogár biolumineszcenciájának evolúciója: a bogár luciferin eredete . In: Luminescence , 19. kötet, 2004. 1. szám, 8-20. O., Doi: 10.1002 / bio.749 (PDF) .
- ↑ a b c J. W. Hastings: A biolumineszcens reakciók kémiai tulajdonságai és színei: áttekintés . In: Gene , Vol. 173, No. 1 special, 1996, 5-11. O. , PMID 8707056 , doi: 10.1016 / 0378-1119 (95) 00676-1 .
- ↑ Osamu Shimomura, Toshio Goto, Frank H. Johnson: A szentjánosbogár luciferin biolumineszcens oxidációjában keletkező CO 2 oxigénforrása . In: Proc Natl Acad Sci USA , 74. kötet, 7. szám, 1977. július, 2799-2802. Oldal, doi : 10.1073 / pnas.74.7.2799 .
- ↑ M. DeLuca, ME Dempsey: Az oxidáció mechanizmusa szentjánosbogár lumineszcenciájában . In: Biochem Biophys Res Commun , 40. kötet, 1. szám, 1970, 117-122. O., PMID 5456946 , doi: 10.1016 / 0006-291X (70) 91054-5 .
- ↑ FI Tsuji, M. DeLuca, PD Boyer, S. Endo, M. Akutagawa: A Cypridina és a szentjánosbogár luciferin enzim-katalizált oxidációjának mechanizmusa 17 O 2 és H 2 18 O módszerekkel vizsgálva . In: Biochem Biophys Res Commun. , 74. kötet, 2. szám, 1977. január, 606-613. Oldal, doi: 10.1016 / 0006-291X (77) 90346-1 .
- ↑ Yoriko Ando, Kazuki Niwa, Nobuyuki Yamada, Toshiteru Enomoto, Tsutomu Irie, Hidehiro Kubota, Yoshihiro Ohmiya, Hidefumi Akiyama: Firefly biolumineszcencia kvantumhozam és színváltozás pH-érzékeny zöld emisszióval . In: Nature Photonics , 2. kötet, 2008, 44-47. O., Doi: 10.1038 / nphoton.2007.251 .
- ↑ Thomas Eisner, Michael A. Goetz, David E. Hill, Scott R. Smedley, Jerrold Meinwald: A Firefly "femmes fatales " védekező szteroidokat (lucibufaginokat) szerez be szentjánosbogár -zsákmányukból . In: Proc Natl Acad Sci USA , 94. kötet, 18. szám, 1997. szeptember, 9723-9728, (PDF) .
- ↑ K. Gomi, N. Kajiyama : Az oxi -luciferin, a szentjánosbogár luciferáz lumineszcens terméke, enzimatikusan regenerálódik luciferinné . In: J Biol Chem . , 276. kötet, 39. szám, 2001, 36508-36513, doi : 10.1074 / jbc.M105528200 (PDF) .
- ↑ Kazuki Niwa, Mitsuhiro Nakamura, Yoshihiro Ohmiya: Sztereoizomer bio-inverziós kulcs a szentjánosbogár D-luciferin bioszintéziséhez . In: FEBS Letters , 580. kötet, 22. szám, 2006, 5283-5287. O., Doi: 10.1016 / j.febslet.2006.08.073 (PDF) .
- ↑ N. Lembert: A Firefly luciferáz L-luciferint használhat fény előállítására. In: Biochem J . , 317. kötet, 1. rész, 1996. július, 273-277. O., Doi : 10.1042 / bj3170273 (PDF) .
- ↑ Yuichi Oba, Naoki Yoshida, Shusei Kanie, Makoto Ojika, Satoshi Inouye: A szentjánosbogár luciferin bioszintézise felnőtt lámpában : Az L-cisztein dekarboxilezése kulcsfontosságú lépés a benzotiazol gyűrűképződésben a szentjánosbogár luciferin szintézisében . In: PLoS ONE , 8. kötet, 12. szám, 2013. december, doi : 10.1371 / journal.pone.0084023 (PDF) ; van erre korrekció .
- ↑ Yuichi Oba, Makoto Ojika, Satoshi Inouye: A Firefly luciferáz egy bifunkciós enzim: ATP-függő monooxigenáz és hosszú láncú zsíros acil-CoA szintetáz . In: FEBS Lett. , 540. kötet, 1-3. Szám, 2003. április, 251-254. O., Doi: 10.1016 / S0014-5793 (03) 00272-2 (PDF) .
- ^ A b Y. Oba, K. Konishi, D. Yano, H. Shibata, D. Kato: A szentjánosbogarak ősi ragyogásának feltámasztása . In: Tudomány fejlődése . szalag 6 , nem. 49. , 2020. december 2., ISSN 2375-2548 , doi : 10.1126 / sciadv.abc5705 , PMID 33268373 , PMC 7710365 (ingyenes teljes szöveg).
- ↑ Stefan Wagner: Fireflies: Lámpás, lámpás, mutasd meg a lámpásodat. Letöltve: 2021. január 27 .
- ↑ Oliver C. Watkins, Miriam L. Sharpe, Nigel B. Perry, Kurt L. Krause: Az új-zélandi izzóféreg (Arachnocampa luminosa) biolumineszcenciáját szentjánosbogár-szerű luciferáz, de teljesen új luciferin állítja elő . In: Tudományos jelentések . szalag 8 , nem. 1 , február 19, 2018, p. 3278 , doi : 10.1038 / s41598-018-21298-w , PMID 29459729 .
- ↑ a b S. M. Marques, JC da Silva Esteves: Firefly biolumineszcencia: a luciferáz katalizált reakciók mechanikus megközelítése . In: IUBMB Life , 61. kötet, 2009. 1. szám, 6-17. O., Doi: 10.1002 / iub.134 .
- ^ A b Osamu Shimomura: Biolumineszcencia: Kémiai elvek és módszerek. Word Scientific Publishing Company, 2006, 249ff, ISBN 981-256-801-8 .
- ↑ a b c d e f g Carlos Fajardo, Marcos De Donato, Hectorina Rodulfo, Gonzalo Martinez-Rodriguez, Benjamin Costas: A Dinoflagellates biolumineszcens rendszeréhez kapcsolódó új perspektívák: Pyrocystis lunula, esettanulmány . In: International Journal of Molecular Sciences . szalag 21 , nem. 5 , 2020. március 5., ISSN 1422-0067 , doi : 10.3390 / ijms21051784 , PMID 32150894 , PMC 7084563 (ingyenes teljes szöveg).
- ↑ D. Morse, AM Pappenheimer Jr., JW Hastings: A luciferin-kötő fehérje szerepe a Gonyaulax polyedra cirkadián biolumineszcens reakciójában . In: J Biol Chem . , 264. kötet, 20. szám, 1989, 11822-11826, (PDF) .
- ↑ D. Morse, M. Mittag: Dinoflagellate luciferin-kötő fehérje . In: Módszerek Enzymol. , 305. kötet, 2000, 258-276. O., Doi : 10.1016 / s0076-6879 (00) 05493-8 .
- ↑ Margaret Fogel, J. Woodland Hastings: Szubsztrátkötő fehérje a Gonyaulax biolumineszcencia reakciójában . In: Arch Biochem Biophys . , 142. kötet, 1. szám, 1971. január, 310-321. Oldal, doi : 10.1016 / 0003-9861 (71) 90289-X .
- ↑ L. Wayne Schultz, Liyun Liu, Margaret Cegielski, J. Woodland Hastings: Egy nyílt tetrapirrol biolumineszcens oxidációját katalizáló pH-szabályozott luciferáz kristályszerkezete . In: Proc Natl Acad Sci USA , 102. kötet, 5. szám, 2005, 1378-1383. Oldal, doi : 10.1073 / pnas.0409335102 (PDF) .
- ^ Margaret Fogel, JW Hastings: Biolumineszcencia: a scintillon aktivitás szabályozásának mechanizmusa és módja . In: Proc Natl Acad Sci USA , 69. kötet, 3. szám, 1972. március, 690-369. O., Doi : 10.1073 / pnas.69.3.690 (PDF) .
- ^ A b T. Wilson, JW Hastings: Biolumineszcencia . In: Annu. Rev. Cell Dev. , 14. kötet, 1998, 197-230, PMID 9891783 .
- ↑ Chun Wu, Hidetoshi Akimoto, Yoshihiro Ohmiya: Tracer vizsgálatok dinoflagellate luciferinnel [ 15 N] -glicinnel és [ 15 N] -l -glutaminsavval a Pyrocystis lunula dinoflagellate -ben . In: Tetrahedron Letters , 44. kötet, 6. szám, 2003., 1263-1266. O., Doi: 10.1016 / S0040-4039 (02) 02815-0 .
- ↑ Lee F. Greer, Aladar A. Szalay: A fénykibocsátás képzése a luciferázok expressziójából élő sejtekben és szervezetekben: áttekintés . In: Luminescence , 17. kötet, 2002. január-február, 43-74. O., Doi: 10.1002 / bio.676 (PDF) .
- ↑ a b c d e f Osamu Shimomura: Biolumineszcencia: kémiai alapelvek és módszerek. Word Scientific Publishing Company, 2006, 30. o., ISBN 981-256-801-8 .
- ↑ a b S. C. Tu: Aktivitás -kapcsolás és komplexképződés a bakteriális luciferáz és a flavin -reduktázok között. In: Photochem Photobiol Sci. , 7. kötet, 2. szám, 2008, 2008, 183-188. O., Doi: 10.1039 / b713462b .
- ^ AJ Fisher, TB Thompson, JB Thoden, TO Baldwin, I. Rayment: A bakteriális luciferáz 1,5 A felbontású kristályszerkezete alacsony sóviszonyok mellett . In: J Biol Chem. , 271. kötet, 36. szám, 1996. szeptember, 21956-21968. Oldal, doi : 10.1074 / jbc.271.36.21956 (PDF) .
- ↑ W. Duane, JW Hastings: Világító baktériumok flavin -mononukleotid -reduktáza. In: Mol Cell Biochem. , 6. kötet, 1. szám, 1975. január, 53-64. O., Doi : 10.1007 / BF01731866 .
- ↑ A. Rodriguez, D. Riendeau, E. Meighen: Az acil -koenzim A reduktáz komponens tisztítása egy komplexből, amely felelős a zsírsavak biolumineszcens baktériumokban történő csökkentéséért. Tulajdonságok és acil -transzferáz aktivitás . In: J Biol Chem. , 258. kötet, 8. szám, 1983. április, 5233-5237. Oldal, PMID 6833298 (PDF) .
- ↑ John Lee, Franz Müller, Antonie JWG Visser: A bakteriális luciferáz szenzibilizált biolumineszcens mechanizmusa . In: Fotokémia és fotobiológia . 2018. november 28., ISSN 1751-1097 , doi : 10.1111 / php.13063 , PMID 30485901 .
- ↑ Osamu Shimomura, Shoji Inoue, Frank H. Johnson, Yata Haneda: A koelenterazin elterjedt előfordulása a tengeri biolumineszcenciában. In: Összeáll. Biochem. Physiol. , 65. kötet, 2. szám, 1980, 435-437, doi: 10.1016 / 0305-0491 (80) 90044-9 .
- ^ AK Campbell, PJ Herring: Imidazolopirazine bioluminescence in coppods and other tengeries . In: Mar. Biol. , 104. kötet, 2. szám, 1990, 219-225 . O. , Doi: 10.1007 / BF01313261 .
- ↑ Osamu Shimomura: A koelenterazin jelenléte nem biolumineszcens tengeri élőlényekben . In: Comp Biochem Physiol. B rész , 86. kötet, 2. szám, 1987, 361-363. Oldal, doi: 10.1016 / 0305-0491 (87) 90306-3 .
- ↑ O. Shimomura, FH Johnson, Y. Saiga: Az aequorin, a biolumineszcens fehérje kivonása, tisztítása és tulajdonságai a világító hidromedusanból, az Aequorea -ból . In: J Cell Comp Physiol . , 59. kötet, 1963. június, 223-239. O., Doi : 10.1002 / jcp.1030590302 (PDF) .
- ↑ Osamu Shimomura, Frank H. Johnson, Hiroshi Morise: Az aekorin lumineszcens intramolekuláris reakciójának mechanizmusa . In: Biochemistry , 13. kötet, 16. szám, 1974. július, 3278-3286. O., Doi : 10.1021 / bi00713a016 .
- ↑ JF Head, S. Inouye, K. Teranishi, O. Shimomura: A fotoprotein aequorin kristályszerkezete 2,3 Å felbontásban . In: Nature , 405. kötet, 6784, 2000. május, 291-293 . Oldal, doi : 10.1038 / 35012659 (PDF) .
- ↑ Osamu Shimomura, Frank H. Johnson: Kalciumkötés, kvantumhozam és kibocsátó molekula aequorin biolumineszcenciában . In: Nature , 227. kötet, 5265. szám, 1970. szeptember, 1356-1357. O., PMID 4393938 .
- ↑ S. Watase: A szentjánosbogár tintahal fényes szerve . In: Dobutsugaku Zasshi , 17. kötet, 1905, 119-123 (japán).
- ↑ Shoji Inoue, Hisae Kakoi, Toshio Goto: Kalmár biolumineszcencia III. A Watasenia luciferin izolálása és szerkezete . In: Tetrahedron Lett. , 17. kötet, 34. szám, 1976. augusztus, 2971-2972. Oldal, doi: 10.1016 / S0040-4039 (01) 85503-9 .
- ^ A b Osamu Shimomura: Biolumineszcencia: Kémiai elvek és módszerek. Word Scientific Publishing Company, 2006, 200. o., ISBN 981-256-801-8 .
- ↑ Katsunori Teranishi, Osamu Shimomura: A világító tintahal Watasenia scintillans karfényszerveinek biolumineszcenciája . In: Biochim Biophys Acta. , 1780. kötet, 5. szám, 2008. május, 784-792. Oldal, doi: 10.1016 / j.bbagen.2008.01.016 (PDF) .
- ^ Frigyes I. Tsuji: A molekuláris oxigén szerepe a szentjánosbogár tintahal, Watasenia scintillans biolumineszcenciájában . In: Biochem Biophys Res Commun. , 338. kötet, 1. szám, 2005. szeptember, 250–253. O., Doi : 10.1016 / j.bbrc.2005.08.215 .
- ↑ a b J. G. Morin: Az adatok áttekintése alapján a „cypridinid” kifejezés megoldja a Cypridina / Vargula dilemmát a Cypridinidae családba tartozó ostrakodák lumineszcens rendszerének alkotóelemeinek megnevezésére . In: Luminescence , 26. kötet, 1. szám, 2011, 1-4. O., Doi: 10.1002 / bio.1178 .
- ^ FH Johnson, O. Shimomura: Enzimatikus és nem enzimatikus biolumineszcencia . In: Photophysiology , No. 7, 1972, 275-334, PMID 4376836 .
- ↑ Shin-ichi Kato, Yuichi Oba, Makoto Ojika, Satoshi Inouye: A Cypridina luciferin bioszintetikus egységeinek azonosítása Cypridina (Vargula) hilgendorfii-ban LC / ESI-TOF-MS . In: Tetrahedron , 60. kötet, 50. szám, 2004, 11427-11434, doi: 10.1016 / j.tet.2004.09.080 (PDF) .
- ↑ Shin-ichi Kato, Yuichi Oba, Makoto Ojika, Satoshi Inouye: Az izoleucin sztereoszelektív beépítése a Cypridina luciferinbe a Cypridina hilgendorfii-ban (Vargula hilgendorfii) . In: Bioscience, Biotechnology, and Biochemistry , 70. kötet, 6. szám, 2006. március, 1528-1532. O., Doi: 10.1271 / bbb.60066 (PDF) .
- ^ Frederick I. Tsuji, Gary B. Leisman: K / Na által kiváltott biolumineszcencia az óceáni kalmárokban Symplectoteuthis oualaniensis . In: Proc Natl Acad Sci USA , 78. kötet, 11. szám, 1981. november, 6719-6723. Oldal, doi : 10.1073 / pnas.78.11.6719 (PDF) .
- ↑ Konstantin V. Purtov, Valentin N. Petushkov, Mihail S. Baranov, Konstantin S. Mineev, Natalja S. Rodionova, Zinaida M. Kaskova, Aleksandra S. Tsarkova, Alexei I. Petunin, Vladimir S. Bondar, Emma K. Rodicheva , Svetlana E. Medvedeva, Yuichi Oba, Yumiko Oba, Alexander S. Arseniev, Sergey Lukyanov, Josef I. Gitelson, Ilia V. Yampolsky: A gomba biolumineszcencia kémiai alapja . In: Angew Chem Int Ed Engl. , 54. kötet, 2015. 28. szám, 8124-8128. O., Doi: 10.1002 / anie.201501779 (PDF) .
- ↑ a b Alexey A. Kotlobay, Karen S. Sarkisyan, Yuliana A. Mokrushina, Marina Marcet-Houben, Ekaterina O. Serebrovskaya, Nadezhda M. Markina, Louisa Gonzalez Somermeyer, Andrey Y. Gorokhovatsky, Andrey Vvedensky, Konstantin V. Purtov, Valentin N. Petushkov, Natalja S. Rodionova, Tatiana V. Chepurnyh, Liliia I. Fakhranurova, Elena B. Guglya, Rustam Ziganshin, Aleksandra S. Tsarkova, Zinaida M. Kaskova, Victoria Shender, Maxim Abakumov, Tatiana O. Abakumova, Inna S. Povolotskaya, Fedor M. Eroshkin, Andrey G. Zaraisky, Alexander S. Mishin, Sergey V. Dolgov, Tatiana Y. Mitiouchkina, Eugene P. Kopantzev, Hans E. Waldenmaier, Anderson G. Oliveira, Yuichi Oba, Ekaterina Barsova, Ekaterina A. Bogdanova, Toni Gabaldón, Cassius V. Stevani, Sergey Lukyanov, Ivan V. Smirnov, Josef I. Gitelson, Fyodor A. Kondrashov, Ilia V. Yampolsky: Genetically encodable bioluminescent system from gombák . In: Proceedings of the National Academy of Sciences . szalag 115 , nem. 50. , 2018. december 11., p. 12728-12732 , doi : 10.1073 / pnas.1803615115 , PMID 30478037 .
- ↑ A tudósok izzó növényeket hoznak létre gomba gének felhasználásával (en) . In: The Guardian , 2020. április 27. Letöltve: 2020. május 18.
- ↑ Tatiana Mitiouchkina, Alexander S. Mishin, Louisa Gonzalez Somermeyer, Nadezhda M. Markina, Tatiana V. Chepurnyh, Elena B. Guglya, Tatiana A. Karataeva, Kseniia A. Palkina, Ekaterina S. Shakhova, Liliia I. Fakhranurova, Sofia V. Chekova, Aleksandra S. Tsarkova, Yaroslav V. Golubev, Vadim V. Negrebetsky, Sergey A. Dolgushin, Pavel V. Shalaev, Dmitry Shlykov, Olesya A. Melnik, Victoria O. Shipunova, Sergey M. Deyev, Andrey I. Bubyrev, Alexander S. Pushin, Vladimir V. Choob, Sergey V. Dolgov, Fyodor A. Kondrashov, Ilia V. Yampolsky, Karen S. Sarkisyan: Növények genetikailag kódolt autolumineszcenciával . In: Természetbiotechnológia . 38., 8. szám, 2020. április 27., 944-946. doi : 10.1038 / s41587-020-0500-9 . PMID 32341562 .
- ↑ Latia-Luciferin külső azonosítói vagy adatbázis-hivatkozásai : CAS-szám:21730-91-6 , PubChem : 5280505 , ChemSpider : 4444143 , Wikidata : Q27102292 .
- ↑ a b O. Shimomura, FH Johnson: A Latia luciferin szerkezete . In: Biochemistry , 7. kötet, 5. szám, 1968, 1734-1738, PMID 5650377 .
- ↑ a b Osamu Shimomura, Frank H. Johnson, Yasuhiro Kohama: Reakciók, amelyek a bolyhos ( Latia neritoides ) és fénylő baktériumok biolumineszcenciás rendszereiben vesznek részt . In: Proc Natl Acad Sci , 69. kötet, 8. szám, augusztus, 2086-2089. O., Doi : 10.1073 / pnas.69.8.2086 (PDF) .
- ↑ a b c d Osamu Shimomura: Biolumineszcencia: kémiai alapelvek és módszerek. Word Scientific Publishing Company, 2006, 182ff, ISBN 981-256-801-8 .
- ↑ a b c d Ohmiya Yoshihiro, Kojima Satoshi, Nakamura Mitsuhiro, Niwa Haruki: Bioluminescence in the limpet-like csiga, Latia neritoides . In: Bull. Chem. Soc. Jpn. , 78. kötet, 2005. 7. szám, 1197-1205. O. , Doi: 10.1246 / bcsj.78.1197 .
- ↑ Mitsuhiro Nakamura, Mizuki Masaki, Shojiro Maki, Ryo Matsui, Minako Hieda, Masashi Mamino, Takashi Hirano, Yoshihiro Ohmiya, Haruki Niwa: Latia luciferin -benzoát analógok szintézise és biolumineszcens aktivitásuk . In: Tetrahedron Letters , 45. kötet, 10. szám, 2004. március, 2203-2205. O., Doi: 10.1016 / j.tetlet.2004.01.027 (PDF) .
- ^ Vadim R. Viviani: A földi biolumineszcencia biológiai és biokémiai sokszínűsége. megtekintve: 2015. május 2.
- ^ A b Osamu Shimomura: Biolumineszcencia: Kémiai elvek és módszerek. Word Scientific Publishing Company, 2006, 238ff, ISBN 981-256-801-8 .
- ^ NG Rudie, H. Ohtsuka, JE Wampler: A luciferin tisztítása és tulajdonságai a biolumineszcens földigilisztából, Diplocardia longa . In: Photochem Photobiol. , 23. kötet, 1. szám, 1976. január, 71–75. O., Doi : 10.1111 / j.1751-1097.1976.tb06774.x .
- ↑ NG Rudie, MG Mulkerrin, JE Wampler: Giliszta biolumineszcencia: a nagy fajlagos aktivitás jellemzése Diplocardia longa luciferáz és a katalizált reakció . In: Biochemistry , 20. kötet, 2. szám, 1981. január, 344-350. O., Doi : 10.1021 / bi00505a018 .
- ↑ a b Maxim A. Dubinnyi, Zinaida M. Kaskova, Natalja S. Rodionova, Mihail S. Baranov, Andrey Yu. Gorokhovatsky, Alexey Kotlobay, Kyril M. Solntsev, Aleksandra S. Tsarkova, Valentin N. Petushkov, Ilia V. Yampolsky: Biolumineszcencia új mechanizmusa: a Fridericia luciferin fénykibocsátójával szomszédos rész oxidatív dekarboxilezése. In: Angew Chem Int Ed. Eng. 54 (24), 2015, 7065-7067. PMID 25913753 ; doi: 10.1002 / anie.201501668
- ↑ Valentin N. Petushkov, Maxim A. Dubinnyi, Aleksandra S. Tsarkova, Natalja S. Rodionova, Mihail S. Baranov, Vadim S. Kublitski, Osamu Shimomura, Ilia V. Yampolsky: A luciferin új típusa a Fridericia szibériai világító földigilisztából heliota: szerkezetek tisztázása spektrális vizsgálatokkal és teljes szintézissel . In: Angew Chem Int Ed Engl. , 53. kötet, 22. szám, 2014. április, 5566-5568. Oldal, doi: 10.1002 / anie.201400529 (kézirat) .
- ^ HA Neufeld, RD Towner, J. Pace: Gyors módszer az ATP meghatározására a szentjánosbogár luciferin-luciferáz rendszerével . In: Experientia , 31. kötet, 3. szám, 1975. március, 391-392. O., Doi : 10.1007 / BF01922604 .
- ↑ Jane-Marie Hawronskyj, John Holah: ATP: univerzális higiéniai monitor . In: Trends Food Sci. Tech. , 8. kötet, 1997. március, 79-84. O., Doi: 10.1016 / S0924-2244 (97) 01009-1 .
- ↑ MR Knight, AK Campbell, SM Smith, AJ Trewavas: Rekombináns aequorin, mint szonda a citoszolmentes Ca2 + -hoz Escherichia coli -ban . In: FEBS Lett . , 282. kötet, 2. szám, 1991. május, 405-408. O., Doi: 10.1016 / 0014-5793 (91) 80524-7 (PDF) .
- ↑ JM Kendall, RL Dormer, AK Campbell: Az aquorin megcélzása az élő sejtek endoplazmatikus retikulumára . In: Biochem. Biophys. Res. Commun. , 189, 2. szám, 1992. december, 1008-1016. Oldal, doi : 10.1016 / 0006-291x (92) 92304-g .
- ↑ Marc R. Knight, Anthony K. Campbell, Steven M. Smith, Anthony J. Trewavas: A transzgénikus növényi aquorin beszámol az érintés és a hideg sokk hatásáról, valamint a kiváltó hatásokról a citoplazmatikus kalciumra . In: Nature , 352. kötet, 6335. szám, 1991. augusztus, 524-526. O., PMID 1865907 .
- ^ Mathias Hampf, Manfred Gossen: A kombinált Photinus és Renilla luciferáz mennyiségi meghatározásának protokollja kompatibilis a fehérje vizsgálatokkal . In: Anal Biochem . , 356. kötet, 1. szám, 2006. szeptember, 94–99. O., Doi : 10.1016 / j ., 2006.04.046 (PDF) .
- ↑ Renilla vizsgálatok. pjk-gmbh.de
- ↑ Kettős luciferáz riporter vizsgálati rendszer. promega.de.
- ↑ Ed Lim, Kshitij D. Modi, Jaebeom Kim: Emlődaganatok in vivo biolumineszcens képalkotása IVIS spektrum használatával. In: J Vis Exp. , 26. kötet, 2009. április, 1210. o., Doi: 10.3791 / 1210 videóval .
- ↑ Caitlin E. O'Connell-Rodwell, Mark A. Mackanos, Dmitrii M. Simanovski, Yu-An Cao, Michael H. Bachmann, H. Alan Schwettman, Christopher H. Contag: In vivo analysis of heat-shock-protein- 70 indukciót lézeres besugárzást követően transzgenikus riporter egérben . In: J Biomed Opt. , 13. kötet, 3. szám, 2008. május, 030501. o., Doi : 10.1117 / 1.2904665 (PDF) .




![\ mathrm {LH_2 + O_2 + ATP \ xrightarrow [Mg ^ {2 +}] {Luciferase} \ oxy \ text {-} L + CO_2 + AMP + PP_i + h \ nu}](https://wikimedia.org/api/rest_v1/media/math/render/svg/910bfa2b41cb3e3e1dbfbafa4289895b5132fa03)