Nyír redukció
A Birch-redukció [ bəːtʃ- ] egy név reakciót a szerves kémiában . Ezek révén aromás rendszerek alkálifémek révén kerülnek át nem aromás rendszerekbe (ún. Dearomatizálás ). A reakciót Arthur Birch fejlesztette ki 1944-ben , Charles B. Wooster és Kenneth L. Godfrey pedig már 1937-ben elkezdett gondolkodni a reakción.
reakció
A reakcióhoz alkálifémeket, például nátriumot vagy lítiumot , ritkán káliumot oldunk folyékony ammóniában . Ez szolvatált elektronokat hoz létre , amelyek tényleges redukálószerként szolgálnak. Ezt felismerhetjük a megoldás mélykék színével. Van alkanol is , pl. B. etanol , proton donorként szükséges. A reakció regioszelektíven folytatódik abban a formában, hogy a protonáció az 1,4-helyzetben megy végbe, vagyis két ellentétes szénatom redukálódik, és két külön kettős kötés jön létre. Ezt a regioszelektivitást a minimális strukturális változás elve magyarázza . Ha oldószerként aminokat használnak ammónia helyett, diének nem képződnek, hanem cikloalkének ( Benkeser-reakció ).
A reakció mechanizmusa
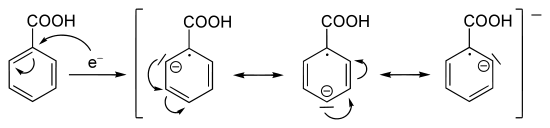
Az első lépésben egy szolvatált elektront viszünk át az aromás gyűrű ellenálló molekuláris pályájára ( LUMO ). Az egyik szénatomon karbanion képződik, míg egy másik radikálissá válik. Ezután a karbanion egy protont vesz fel egy etanol molekulából. Az etanolt csak nagyon lassan redukálják a szolvatált elektronok, így hozzáadható a tényleges reakció előtt.
Egy másik karbanion úgy alakul ki, hogy az oldatból további elektront vesz fel. Ez reagál egy második etanol-molekula protonjával, és így képezi az 1,4-dihidrogénezett terméket.
Meg kell jegyezni, hogy a fennmaradó két kettős kötés mindig pontosan egymással szemben helyezkedik el. Tehát nem alakul ki konjugált rendszer .
Reakció benzolszármazékokon
Szubsztituensek az aromás gyűrűben befolyásolják a regioszelektivitása első protonálódás a radikális anionos gyűrűt. Attól függ, hogy ez elektron-akceptor szubsztituens (negatív I hatású szubsztituens) vagy elektron donor szubsztituens (pozitív M hatású és / vagy pozitív I hatású szubsztituens ). Maga A. Birch a donor szubsztituensek (például hidroxil- vagy étercsoportok ) minőségi szempontjai alapján kezdeti protonációt feltételezett a szubsztituens meta- helyzetében. Manapság azonban ezt a nézetet mind a kvantummechanika területén végzett elméleti munka, mind pedig a kísérletek megcáfolták, és bebizonyosodott egy kezdeti protonáció az orto helyzetben.
Ha viszont van egy akceptor szubsztituens az aromáson, akkor az első protonáció a szubsztituens para helyzetében vagy ipso-ban megy végbe . Az átmeneti állapotok nagyobb stabilitása felelős ezért .
Az anizolok 1-metoxi-ciklohexa-1,4-diének képződésére reagálnak, feltéve, hogy más szubsztituensek nincsenek befolyással. Az anizolból képződött 1-metoxi-ciklohexa-1,4-dién vizes-savas közegben protonnal katalizált éterhasításon megy keresztül. A közvetlen termék egy instabil enol, amely további proton-katalízissel ( keto-enol-tautomerizmus ) spontán átrendeződik a ciklohex-3-enon révén a stabilabbá (a kettős kötések konjugációja miatt) a 2-ciklohexen-1-on . Ez az úgynevezett α, β-telítetlen keton az u. a. kiindulási anyagként Michael-kiegészítésekhez .
fontosságát
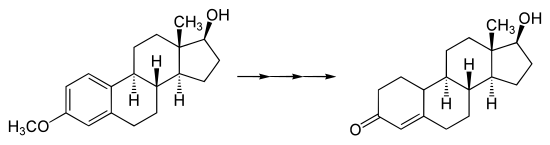
A nyír csökkentése különös jelentőséggel bír a szteroidok szintézisében . A C19 szteroidokat szintetizáltuk az anizolszármazékok Birch-redukciójával. (itt a metilezett ösztradiol példáján keresztül ):
Többek között az első hatóanyag, amelyben a fogamzásgátló tabletta ösztrogén- noretisteront használt, vagy az első szintetikusan előállított anabolikus szteroid- nandrolon egy szintetizált nyírfacsökkentés révén.
irodalom
- Reinhard Brückner: reakciómechanizmusok. 3. kiadás, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 .
- Kürti László , Czako Barbara: A megnevezett reakciók stratégiai alkalmazásai a szerves szintézisben . Academic Press, 2004, ISBN 0-1242-9785-4 .
Egyéni bizonyíték
- ↑ Arthur J. Birch: Redukció fémek oldásával. I. rész : In the Journal of the Chemical Society (Resumed). 1944, 430-436. Oldal, doi : 10.1039 / JR9440000430 .
- ^ Charles Bushnell Wooster, Kenneth L. Godfrey: A telítetlen vegyületek alkálifémekkel és vízzel történő redukciójának mechanizmusa. In: J. Am. Chem. Soc. 59, 1937. 3. sz., 596–597. Oldal, doi : 10.1021 / ja01282a504 .
- ↑ a b c d e Reinhard Brückner: reakciómechanizmusok. 3. kiadás, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , 808-809.
- ^ Stefan Kubik: Nyírfacsökkentés. In: Römpp kémiai lexikon. Thieme, 2004. augusztusától.
- ↑ Birch, AJ, Nasipuri, D.: Reakciómechanizmusok a redukciókban a Metal-Ammonia Solutions segítségével , Tetrahedron 1959, 148-153.
- ^ Howard E. Zimmerman: Tájékozódás a fém-ammónia redukcióiban. In: Tetrahedron. 16, 1-4, 1961, 169-176 . O. , Doi : 10.1016 / 0040-4020 (61) 80067-7 .
- ^ HE Zimmerman: Alapkatalizált átrendeződések In: Paul De Mayo (Szerk.): Molekuláris átrendeződések. Interscience Publishers, New York 1963, 6. fejezet, 345-406.
- ^ A b Howard E. Zimmerman, Patricia A. Wang: A Birch-redukció regioszelektivitása. In: Az American Chemical Society folyóirata. 112, 3. szám, 1990, 1280-1281 . O. , Doi : 10.1021 / ja00159a078 .
- ^ A b Arthur J. Birch: A Birch redukció a szerves szintézisben. In: Tiszta és alkalmazott kémia . 68, 3. szám, 1996, 553-556. Oldal ( teljes szöveg, pdf ).
- ↑ Carl Djerassi, L. Miramontes, G. Rosenkranz, Franz Sondheimer: Szteroidok. LIV. 19-Nov-17a-etinil-szteroszteron és 19-Nor-17a-metiltesztoszteron2 szintézise. In: Az American Chemical Society folyóirata. 76, No. 16, 1954, p. 4092-4094, doi : 10.1021 / ja01645a010 .