Valós idejű kvantitatív PCR
A valós idejű kvantitatív PCR vagy angol. A valós idejű kvantitatív PCR ( qPCR rövid vagy Real Time Detection PCR , röviden RTD-PCR ) a nukleinsavak replikációs módszere , amely a hagyományos polimeráz láncreakció (PCR) elvén alapszik, és lehetővé teszi a kapott DNS számszerűsítését is . A qPCR-t néha kétértelműen fordított transzkripciónak nevezik a későbbi q-PCR-rel (ugyanabban a megközelítésben), mint a qRT-PCR-t vagy az RT-qPCR-t .
A kvantifikálást fluoreszcenciával végzett mérésekkel valósítottuk meg (PCR ciklus alatt, valós időben ). A fluoreszcencia a PCR-termékek mennyiségével arányosan növekszik. A több ciklusból álló futtatás végén a kvantifikálást a PCR exponenciális fázisában hajtjuk végre a kapott fluoreszcencia jelek alapján. A helyes kvantifikáció csak a PCR exponenciális fázisában lehetséges (amely egy ciklusban néhány ciklust tart), mivel ebben a fázisban az optimális reakciókörülmények uralkodnak. Ez a módszer különbözik a többi kvantitatív PCR-eljárástól (qPCR), amely csak a PCR befejezése után végez kvantitatív értékelést (például kompetitív PCR-t ), amely általában magában foglalja a PCR-fragmensek gélelektroforetikus elválasztását.
A valós idejű kvantitatív PCR más célokra is felhasználható, pl. B. megkülönböztetni a homozigóta és a heterozigóta jellemzőket.
Az RT-PCR vagy qRT-PCR rövidítést néha használják a qPCR-re. Ez azonban zavart vezet, mivel ezt a rövidítést már használják a reverz transzkriptáz-polimeráz láncreakcióhoz .
Mód
Színezékek
A PCR-termékek mennyiségi meghatározásának legegyszerűbb módja a DNS-színezékek (pl. Etidium-bromid vagy SYBR Green I ) alkalmazása. Ezek a fluoreszcens színezékek vannak letétbe a DNS egy (interkalátvegyületek) és megkötik (a kisebb horony a kettős szálú DNS-t angol minor groove kötőanyag ), miáltal a fluoreszcens növekedés ezen színezékek. A festett cél DNS növekedése tehát összefüggésben áll a fluoreszcencia ciklusonként történő növekedésével. A mérésre minden egyes ciklusban a megnyúlás végén kerül sor.
Ennek a módszernek hátránya az alacsony specificitás, mivel nem lehet különbséget tenni a különböző PCR-termékek között. Ezen kívül multiplex méréseket nem lehet végrehajtani. Az első hátrány kompenzálható egy olvadási görbe elemzés elvégzésével a PCR befejezése után, amely alapján meghatározható a fragmens hossza (i) és ezáltal a specificitás.
Egy olvadási görbe analízisen , a DNS-t megolvasztjuk, a hőmérséklet lassú növelése folyamatosan (50 ° C → 95 ° C-on). A fragmens meghatározott olvadási hőmérsékletén a kettős szál denaturálódik két egyszálú molekulává. Fluoreszcens festék (pl. SYBR Green I) szabadul fel, és regisztrálják a fluoreszcencia változását. A dsDNS-fragmens olvadási görbéje és olvadási hőmérséklete lényegében a DNS-fragmens hosszától és bázisösszetételétől függ. Az olvadási görbe elemzésével információkat nyerhetünk a PCR reakció specifitásáról. Mivel a specifikus PCR-termékek kettős szálú DNS-nek magasabb az olvadáspontja, mint a nem specifikus primer dimereknek, megkülönböztetés lehetséges. Az olvadási görbe elemzés másik felhasználása a különböző PCR-termékek (különböző DNS-szekvenciák, esetleg különböző fragmensméretek) összehasonlítása és differenciálása olvadási viselkedésük szempontjából. Sok esetben az olvadási görbe úgy jelenik meg, hogy a fluoreszcencia jel első deriváltjának (y tengely) abszolút értékét ábrázoljuk a hőmérséklettel (x tengely) szemben. Az így ábrázolt olvadási görbe csúcsok jellemzőek egy adott PCR-termékre, ezért az olvadási görbe-elemzést alkalmazzák a PCR-termék kvalitatív vizsgálatára. Az olvadási görbe csúcsainak magassága (vagy egyéb jellemzője) nem paraméter a DNS mennyiségének számszerűsítésére.
FRET szondák
Egy másik lehetőség a Förster-rezonancia energiaátadás (FRET) használata. A donor fluorokróm (riporter - a TaqMan szondákkal kapcsolatban), amelyet egy fényforrás gerjeszt, energiájának egy részét egy kellően közeli akceptor fluorokrómnak (vagy egy sötét csillapítónak adja - TaqMan szondákkal kapcsolatban) adja le. . Ha az akceptor és a donor közötti távolság nő, akkor a FRET és ezáltal az akceptor fluoreszcencia jele csökken, míg a donoré nő. Ez a módszer nagyon összetett és költséges, de a vizsgálat magas specifitásának előnyeit kínálja .
LightCycler szondák (hibridizációs szondák is)
A nukleinsavak mennyiségi meghatározásához a FRET használatának legegyszerűbb módja a LightCycler szondák használata. Két különböző oligonukleotid , amelyek mindegyike FRET donorral vagy FRET akceptorral van jelölve (itt riporter) , amelyek egymás mellett kötődnek a célszekvenciához, és így a fluorokrómokat elég közel hozzák a FRET-hez, használhatók próbaként a PCR mennyiségi meghatározásához. -Termékeket használnak. A mérés az egyes ciklusok hőkezelési szakaszának végén történik. Olvadási görbe elemzés következhet itt is.

LoopTag szondák
A FRET elvet a LoopTag szondarendszerben is alkalmazzák. Ez a rendszer egy előreinduló primerből áll, amelynek 5'-végén egy szekvencia-nem specifikus nukleotid-szekvencia és a fluoreszcencia-akceptor kapcsolódik. A másik rész a detektáló szonda (LoopTag próba), amelyhez szekvencia-nem specifikus nukleotid szekvencia és a donor kapcsolódik a 3 'végén. A LoopTag szonda 5'-vége hibridizálódik specifikusan a célszekvenciával és specifikusan a 3'-végén lévő kiterjesztett előreindítóval. A detektáló szonda és az előremenő primer szekvencia-nem specifikus nukleotidszekvenciái hibridizálnak egymással, hogy próba-primer hurkot képezzenek és szárat képezzenek. A terminális festékek (donor / szonda, akceptor / primer) ebből adódó térbeli közelsége lehetővé teszi az energiaátadást.
TaqMan szondák (hidrolízis szondák is)
A FRET másik gyakran használt lehetősége egy olyan szonda használata, amelyet egyik végén oltóval és riporter fluoreszcens festékkel (pl. TAMRA és FAM ) jelöltek ( kettős festék oligók , TaqMan Szonda ). Ha a Taq-polimeráz , amely a polimeráz aktivitás mellett 5'-3 ' exonukleáz aktivitással rendelkezik, az 5' végén lévő ellentétes szál szintézise során lebontja a szondát, a csillapító és a fluorofór elmozdul egymástól, és a riporter fluoreszcenciája megnő mérhető. A mérésre minden egyes ciklusban a megnyúlás végén kerül sor.
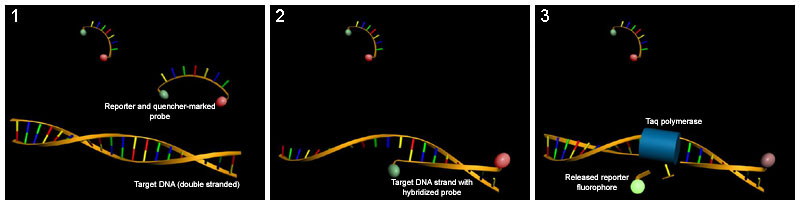
Molekuláris jelzők
A PCR-termékek valós idejű kvantifikálásának másik lehetősége a FRET alkalmazásával a molekuláris jelzők használata próbaként. A molekuláris jeladók olyan oligonukleotidok, amelyek egy riporter fluoroforhoz és egy csillapítóhoz is kapcsolódnak. A próba 5 'végén található nukleotidok kiegészítik a 3' végén lévő nukleotidokat, így kialakulhat egy molekuláris jelzőfényekre jellemző másodlagos szerkezet. Ebben az állapotban, amelyet szárhurokként (hajtűszerkezetként) ismernek , a riporter nem mutat fluoreszcenciát a kioltótól való kis távolsága miatt. Ha a hurokrégiót egy komplementer DNS-szekvenciához adjuk egy PCR-ciklus alatt, megnő a távolság a kioltó és a riporter között. A riporter fluoreszcenciája megfigyelhető.
Skorpió alapozó
A Scorpion primerek olyan komplex oligonukleotidok, amelyek a valós idejű PCR szondák és a PCR primerek tulajdonságait ötvözik egy (Uni-Scorpion) vagy két molekulában (Bi-Scorpion). A molekuláris jelzőkhöz hasonlóan jellegzetes másodlagos szerkezetük van, önkomplementer tengelyrégióval, amelynek végeit riporter fluoroforral és oltóval módosították. Ezenkívül ezek a próbák PCR-primert hordoznak a 3'-végén. A PCR-ciklus során, növekvő DNS-koncentráció mellett, a riporter fluoreszcenciája figyelhető meg, mivel a hurokrégió kapcsolódik egy komplementer DNS-szekvenciához, és ezáltal megnő a távolság a kioltó és a riporter között.
Lux alapozó
A lux primerek olyan fluoreszcens festékkel jelölt oligonukleotidok, amelyek fluoreszcencia intenzitása a kémiai környezetüktől függ. Ha ezeket a primereket beépítjük egy DNS-be egy PCR során, akkor megfigyelhető a fluoreszcencia növekedése.
Lantanoid jelzésű próbák
A lantaniddal jelzett próbák 5 'végén egy lantaniddal , például európiummal vagy terbiummal vannak jelölve és oligonukleotiddal hibridizálva, a 3' véget beoltott jelzéssel látják el.
számszerűsítés
A kvantifikáláshoz különféle számítási modelleket alkalmaznak, általában egy referencia gént (pl. GAPDH , aktin , tubulin ) is mérnek a relatív mennyiség-összehasonlítás (relatív kvantifikáció) elvégzése érdekében. Más, sokkal bonyolultabb módszerek célja az abszolút számszerűsítés lehetővé tétele, amelyben meghatározható a mintában jelen lévő sablonok pontos száma .
Ct érték vagy Cp érték is
A PCR amplifikációjának első fázisában a templát mennyisége korlátozott, és a templát, a primer és a polimeráz találkozásának valószínűsége szuboptimális, míg az amplifikáció harmadik fázisában a termékek (DNS, pirofoszfát, monofoszfát nukleotidok) mennyisége olyan mértékben növekszik, hogy gátlás következik be, a termékfragmensek gyakrabban hibridizálnak egymással, a szubsztrátok lassan elhasználódnak, és végül a polimerázok és nukleotidok lassan elpusztulnak a hő hatására. Exponenciális és ezért számszerűsíthető növekedés csak a kettő közötti szakaszban található meg. A PCR exponenciálisan megmarad 12–400 kezdeti példányban kb. 30 ciklusig, 200–3200 25 ciklusig és kezdetben 3200–51200 legfeljebb 20 ciklusig. Annak érdekében, hogy mindig képes mérni az elején az exponenciális fázisban a Ct érték ( küszöb ciklus a küszöbérték ciklus), illetve a Cp értéke ( határátkelőhely ) gyakran használják, amely leírja a ciklus, amelyben a fluoreszcencia jelentkezik az első alkalommal jelentősen megnő a háttér fluoreszcencia felett.
Hatékonyság
A hatékonyság többféleképpen számolható, amelyek eredményükben kissé eltérnek. A legegyszerűbb módszer a következő:
Az E hatásfok kiszámítható egy standard görbe m meredekségével. Erre a célra cDNS- hígítási megközelítést (pl. 100%, 10%, 1%, 0,1%) alkalmaznak a qPCR-hez, és a megfelelő Ct értékeket használják görbe grafikus előállításához. A görbén átmenő lineáris regressziós vonal meredeksége -m (növekvő DNS-koncentráció esetén ábrázolva).
Az −3,32 m lejtés tehát 1 (100%) hatékonyságot jelentene, azaz H. az amplifikátumok ciklusonkénti megduplázódása, –3,58 meredekség, hatásfoka 0,9 (90%). A képlet csak a −3,32-nél kisebb lejtésértékek esetén nyújt 100% alatti értelmes értékeket.
Abszolút számszerűsítés
Az abszolút számszerűsítés időigényes és az eredmények megkérdőjelezhetők, ezért ritkán hajtják végre ezt a típusú kvantifikációt. Meg kell határozni többek között a reverz transzkripció hatékonyságát , amely 5 és 95% között lehet, pl. B. ismert mennyiségű szintetizált RNS alkalmazásával.
Relatív számszerűsítés
Ehhez belső ellenőrzés szükséges. A belső kontroll lehet egy gén transzkriptum, amelynek szignáljával kompenzálják a felhasznált RNS kezdeti mennyiségének változásait. Erre z. B. Használt háztartási gének . A mennyiségek összehasonlítását a háztartási génekkel normalizálásnak nevezzük. Mivel az átfogó elemzés ezen a jelen alapul, a belső kontroll megválasztása a kísérlet fontos szempontja.
Az ideális belső kontroll könnyen felismerhető, és expressziója nem változhat a sejttartás során, sejttípusok között vagy a kísérleti kezelésre (például stressz, gyógyszeres kezelés, betegség) adott válaszként.
Számítás standard görbe segítségével
Lineáris, fordítottan arányos kapcsolat van a felhasznált mennyiség logaritmusa és a Ct között. Ha a kezdeti mennyiség ismert, akkor egy standard görbe készíthető úgy, hogy a kezdeti mennyiség logaritmusát ábrázoljuk a Ct-vel. Az egyenes egyenlet alapján
- x = (Ct - b) / m
a példányszám logaritmusa meghatározható minden ismeretlen minta standard görbéjéből. Az összes mintát úgy normalizáljuk, hogy a célgén kiszámított példányszámát elosztjuk a belső referencia példányszámával:
- Gén (normalizált) = cél példányszám / referencia példányszám
Két minta egymáshoz viszonyított eltérő kifejezése hányadosként ábrázolható, és n-szeres kifejezést eredményez:
- Gén (normalizált) (A csoport) / gén (normalizált) (B csoport) = az A-expresszió n-szeres csoportja a B csoport felé
Számítás ΔΔCt módszerrel
A különböző kifejezést n-szeres expresszióként jelöljük a ΔΔCt érték segítségével. Ebben a folyamatban fontos, hogy a két érintett PCR reakció egyformán hatékony legyen. Először a célgén és a referencia Ct-értékeit levonjuk egymásból (ΔCt) annak érdekében, hogy az egyes csoportok (pl. Beteg / egészséges, hatóanyaggal / anélkül) két ΔCt értéke közötti különbség alakuljon ki (ΔΔCt- Érték). Az így kapott értéket használjuk az n-szeres egyenletben (A és B csoport) = 2 −ΔΔCt .
Új kvantifikációs algoritmusok
A relatív kvantifikáció pontosságának javítása érdekében különféle, részben ΔΔCt módszeren alapuló megközelítéseket dolgoztak ki.
- A ΔΔCt módszer képletének kiterjesztése a megfelelő PCR-megközelítés hatékonyságával, amelyet előzetesen meg kell határozni egy próbaüzemben, standard görbe alkalmazásával.
- Használata regressziós analízis módszerek, egy adaptációja a qPCR adatkészletek egy exponenciális függvényt , vagy linearizált formában, hogy egy egyenes vonal egyenletet . Ezeknek a függvényeknek az y tengellyel való metszéspontja ezután információt nyújt a kötegben eredetileg jelenlévő DNS mennyiségéről (relatív információ egy referencia mintához képest).
- A qPCR adatok adaptálása három vagy több paraméteres sigmoid függvényhez . Itt is meghatározzuk a DNS relatív mennyiségét y (0) -on keresztül.
Ezen új, többnyire még nem piacképes módszerek előnyei a pontosabb elemzésben és a PCR eredmények alacsonyabb szórásában rejlenek . Egyes módszereknél a hatékonyságot minden egyes minta-előkészítés során figyelembe veszik, és ezáltal egyetlen csőelemzést tesznek lehetővé .
Az eredmények reprodukálhatósága és összehasonlíthatósága
Egy kísérlet semmit sem ér, ha nem ismételhető meg. Ehhez feltétlenül állandó a vizsgálati körülményeket. Nemcsak a vizsgálat minőségének (primer, szondák, polimeráz, puffer stb.) Konzisztenciáját kell figyelembe venni, hanem az eszközöknek is meg kell felelniük a követelményeknek. Például blokkrendszerekben (96 vagy 384 kút) az úgynevezett homogenitás a fő kritérium. Az assay-knek ugyanolyan jól kell futniuk a blokk minden egyes kútjában, és azonos eszközök blokkjain is. Ez a homogenitás továbbá nem változhat az idők során. Annak biztosítása érdekében, hogy az eszközt biztonságos laboratóriumi kísérletekhez lehessen használni, rendszeres időközönként megfelelő ellenőrzéseket kell végrehajtani (egyes modellek rendkívül hajlamosak az öregedésre). Egy vizsgálatot sok ismétlésben elemeznek, az egész blokkra elosztva. Ideális esetben az eredménynek mindenhol azonosnak kell lennie. Most a kísérletezőnek tisztában kell lennie azzal, hogy az eltéréseknek milyen mértékben lehet releváns hatása is. Ezeket az eltéréseket nem lehet kompenzálni drága ismétlésekkel, mivel ezeket is folyamatosan ismételnék.
irodalom
- Bianca Holzapfel és Lucia Wickert (2007): A kvantitatív valós idejű PCR (qRT-PCR). In: Biológia korunkban. 37. évfolyam, 2. szám, 120–126. doi : 10.1002 / biuz.200610332
- Michael Walter Pfaffl (2004): Valós idejű RT-PCR: Új megközelítések a pontos mRNS mennyiségi meghatározásához. In: Biospectrum. PDF
- Bustin SA és mtsai. (2009): "A MIQE irányelvek: minimális információ a valós idejű kvantitatív PCR-kísérletek publikálásához." Clin Chem. 2009 ápr .; 55 (4): 611-22. PDF
web Linkek
- www.gene-quantification.info angol oldal, amely minden tudást, tippet és trükköt tartalmaz a qPCR-ről
- realtimepcr.dk Valós idejű PCR (Koppenhága)
- RefGenes Open Access online eszköz a szövetspecifikus referenciagének azonosításához
- RT-PCR-article.pdf (PDF, 276 kB, jó cikk angolul)
Egyéni bizonyíték
- Nur J. Nurmi, T. Wikman, M. Karp, T. Lövgren: nagy teljesítményű, valós idejű kvantitatív RT-PCR lantanid szondákkal és kettős hőmérsékletű hibridizációs vizsgálattal. In: Analitikai kémia. 74. évfolyam, 14. szám, 2002. július, 3525-3532. Oldal, ISSN 0003-2700 . PMID 12139064 .
- ↑ A. Lehmusvuori, AH Tapio, P. Mäki-Teeri, K. Rantakokko-Jalava, Q. Wang, H. Takalo, T. Soukka: Homogén duplex polimeráz láncreakciós vizsgálat kapcsolható lantanid-fluoreszcencia szondákkal. In: Analitikai biokémia. 436. évfolyam , 1. szám, 2013. május, 16–21. Oldal, ISSN 1096-0309 . doi : 10.1016 / év 2013.01.007-től . PMID 23353013 .


