Ubiquitin
| Ubiquitin | ||
|---|---|---|

| ||
| Szalag modell | ||
| Az emberi fehérje tulajdonságai | ||
| Tömeg / hosszúság elsődleges szerkezet | 8,5 kDa / 76 aminosav | |
| Azonosító | ||
| Génnevek | RPS27A ; UBA52; UBB; UBC | |
| Külső azonosítók | ||
| Esemény | ||
| Szülő taxon | Eukarióták | |
Az ubiquitin egy kicsi fehérje , amely minden eukarióta sejtben és sejttípusban megtalálható - vagyis az eukariótákban mindenütt jelen van -, és részt vesz a különféle sejtfolyamatok szabályozásában.
Ez enzimatikusan kapcsolódik más fehérjékhez az ubiquitin protein-ligázok segítségével , amelyek tulajdonságait ez az ubiquitináció megváltoztatja. Az ubiquitin kötések számától és típusától függően az ubiquitinezett célfehérje elősegíthető vagy akadályozható más fehérjékkel való kölcsönhatásában, befolyásolható aktivitása, megváltozhat a sejtben való lokalizációja vagy felgyorsulhat a lebomlása. Számos, egy láncba kapcsolt ubiquitin jelöli az így poli-ubiquitinezett fehérjét a fehérje minőségének ellenőrzésében a proteaszómában történő lebontás érdekében . Az ubikvitinációk szintén fontosak a transzkripció és a transzláció szabályozásában , részt vesznek a szignáltranszdukcióban és az endocitózisban, részt vesznek a DNS-helyreállításban, és a sejtciklus , a sejtdifferenciálódás és a gyulladásos reakciók szabályozott folyamataiban fordulnak elő .
Maga az ubikvitináció egy többfázisú folyamat, amelynek három fő lépését különböző enzimek katalizálják: ubiquitin-aktiváló (E1), ubiquitin-konjugáló (E2) és végül ubiquitin-ligázok (E3), amelyek az ubiquitin-t bizonyos szubsztrátfehérjékhez kötik. különböző utak.
Másrészről számos különféle desubikvitinizáló enzim (DUB) létezik, amelyek specifikus hatása alatt többek között a kapcsolódó ubiquitin molekulák ismét eltávolíthatók.
Ubiquitináció, és ubikvitináció nevezett, egy poszt-transzlációs módosítást van a fehérjék. Összehasonlítható módosítások tengelykapcsolók ubiquitin-szerű fehérjék, mint például SUMO , Urm1 vagy NEDD8 megfelelő sumoylation , Urmylierung vagy neddylation említett. Ezenkívül néhány prokarióta , például a Mycobacterium tuberculosis , ismeri az ubiquitin analóg fehérjét, amelyet prokarióta ubiquitin-szerű fehérjének (Pup) neveznek .
Az ubikvitint 1975-ben fedezték fel (az úgynevezett mindenütt immunopoetikus polipeptidet ), és a következő években részletesebben jellemezték. Az 1980, Aaron Ciechanover , Avram Hersko és Irwin Rose került oda a kémiai Nobel-díjat azok kutatások alapjait az ubiquitin rendszer .
szerkezet
Az ubiquitin áll a 76 aminosavból , és van egy molekulatömege 8,5 kD . Szerkezete az evolúció során alig változott , ezért erősen konzervált . Az emberekben lévő fehérje és a Saccharomyces cerevisiae egysejtű élesztő a 76 aminosav közül csak 3-ban különbözik egymástól.
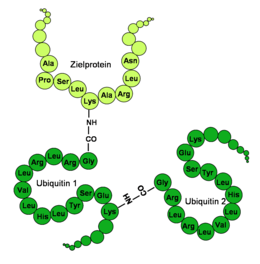
Az ubiquitin gömb alakú, csak az utolsó négy C- terminális aminosav áll ki. Fontos funkcionális aminosavak a C- terminális glicin (G) a 76. pozícióban (G76) és a lizinek (K) az aminosavszekvencia 48. (K48) és 63. pozíciójában (K63) . A G76- on lévő C- terminális karboxi-csoporton keresztül az ubiquitin kovalensen kötődik a specifikus lizinekhez, ciszteinekhez, szerinekhez, treoninokhoz vagy a jelölendő fehérje N- végéhez . A lizineken keresztül további ubiquitin molekulák kapcsolódhatnak egy már megkötött ubiquitinhez, így ubiquitin lánc képződik. Mivel az ubiquitin összesen hét lizint tartalmaz, az ubiquitin legalább hét különböző típusú vegyülete lehetséges.
Az emberi ubiquitin aminosavszekvenciája egy betűs kódban - K48, K63 és G76 félkövérrel kiemelve:
| N -term MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG C -term |
Az ubikvitináció mechanizmusa
A célfehérjék ubiquitinnel történő jelölésének folyamatát ubiquitinációnak vagy ubiquitinationnek nevezzük . Melyik eljárás megköveteli - mint sumoylation , Urmylierung vagy neddylation - több egymást követő reakciólépések , és a három enzim katalizálja , ubikvitin-protein ligázok , amely szerint a reakciósor például E1 (aktiváló és módosítási enzim), E2 (szintén módosítás konjugáló enzimet) és az E3-ot (szintén az E3- ligázt ) jelöljük.
Az első lépésben, az ubiquitin kötődik egy tioészter kötést közötti C -terminális karboxil-csoport (G76) és egy cisztein a az E1 enzim, és így „aktivált”. Ez az aktiválás energiafüggő; A szükséges energiát az hasító ATP be AMP és pirofoszfát . Van egy speciális E1 enzim a módosító molekula aktiválására, a növényekben pedig akár két E1 enzim is található az ubiquitin számára.
Miután az ubiquitin kapcsolódott az E1-hez, az ubiquitin átkerül az E2 enzimbe. Több mint tizenegy különböző E2 enzim ismeretes az ubiquitin esetében önmagában az élesztőben; más organizmusokban ezek száma még nagyobb (míg a Sumo1 és a Nedd8 esetében egy-egy speciális E2 enzim létezik).
Az utolsó lépésben az ubiquitint specifikus E3 ligázok viszik át a célfehérjébe. Itt izopeptid kötés jön létre az ubiquitin C- terminális glicinje és a célfehérje lizinje között. A klasszikus peptidkötéssel ellentétben nem az a-amino-maradék, hanem a lizin e-amino-maradéka szolgál kötési partnerként. Ezenkívül az ubiquitinek más módon is összekapcsolhatók, és lizinmentes fehérjéket is ubiquitináltnak találtak. Az ubiquitin által módosított célfehérjék sokféleségét a különféle E3 enzimek száma tükrözi. Ha figyelembe vesszük az összes olyan enzimet, amelyek szerkezetileg az E3 enzimek három alcsaládjához (HECT, RING és U-Box) tartoznak, akkor a magasabb rendű organizmusok esetében több száz és ezer közötti számot lehet feltételezni.
Az ubiquitáció típusai
Az ubiquitinek különböző módon kötődhetnek az adott célfehérjéhez, mások pedig különböző pontokon. Az összekapcsolt ubiquitin molekulák száma szerint megkülönböztetik a mono- és az oligo-, a multi- vagy a poli-ubiquitinációt, attól függően, hogy csak egy molekula van-e, vagy kevés, több vagy sok-e az ubiquitin.
Ha legalább öt ubiquitin molekula kapcsolódik láncként egy célfehérjéhez, akkor az egyik a poli-ubiquitinációról beszél. Ha ezek a molekulák kapcsolódnak egymáshoz a 48-as lizinnél (K48), akkor a célfehérjét elsősorban a proteaszóma bontja . A 63-as lizinnél (K63) történő kapcsolódás a fehérje lizoszómális lebomlásához vezethet . Megfigyelték továbbá, hogy ez a módosítás befolyásolja a DNS károsodás , a gyulladásos immunválasz, az endocitotikus folyamatok és a riboszomális fehérjeszintézis sejt toleranciáját .
A mono- és multi-ubiquitinációk viszont kevésbé befolyásolják az egyes fehérjék stabilitását, mint az intracelluláris eloszlásuk, és lehetővé tehetik a kölcsönhatást más fehérjékkel. Az oligo-ubikvitináció például befolyásolja a transzkripciós faktor aktivitását anélkül, hogy megindítaná annak lebomlását.
Példák az ubikvitinációra
A helytelenül hajtogatott fehérjék lebontása
Az ubiquitin proteaszóma rendszer fontos szerepet játszik az intracellulárisan előállított fehérjék "minőségbiztosításában". A fehérjék működésének előállítása alatt és után is megfelelően fel kell hajtani őket. Néhány fehérje hajtogatása ugyanolyan összetett és hibára hajlamos, mint a hámsejtekben a CFTR kloridion-csatorna , amelyben a termelődő fehérjék akár 60-80% -a is hibásan van hajtva. Ezeket a helytelenül összehajtott fehérjéket úgynevezett kaperonok , enzimek kötik meg , amelyek bizonyos körülmények között elősegíthetik a fehérje helyes hajtogatását. „Helyrehozhatatlan” rossz hajtogatás esetén egy protein-chaperone-ubiquitin-E3 ligáz komplex képződését figyelték meg, amely poli-ubiquitinizálja a rosszul összehajtott fehérjét, és így lehetővé teszi a proteaszóma általi lebontást. Ily módon biztosítható, hogy strukturálisan degenerált fehérjék sem citozolikusan, sem membránnal társulva ne befolyásolják a sejtfolyamatokat.
Ha azonban az ioncsatorna CFTR esetében mutáció következik be a kódoló DNS-ben , ami az 508-as helyzetben lévő fenilalanin mutációjában tükröződik (F508), ez poli-ubiquitinációhoz és az összes CFTR fehérje idő előtti lebomlásához vezet előállított. Az eredmény a cisztás fibrózis klinikai képe . Bár a mutált ioncsatorna fehérje nem tud megfelelően működni, idő előtt lebomlik. Ez a példa azt mutatja, hogy a strukturálisan helytelen fehérjék ubiquitin által közvetített lebontásának szigorú ellenőrzési rendszere, amelynek valójában pozitív hatása van, szintén negatív hatással lehet a szervezetre.
Az átírás szabályozása
Az első lépés a fehérje szintézist is transzkripció . Itt a DNS-t átírják RNS- be egy enzim, az RNS-polimeráz segítségével . A polimeráz transzkripciós indításához számos részt vesz a szükséges DNS transzkripciós faktorokban . A DNS hozzáférhetősége a transzkripciós faktorok és a polimeráz számára állandóan DNS-hez kötött fehérjekomplexekkel, a hisztonokkal szabályozható . A DNS-be „burkolt” hisztonokat nukleoszómáknak nevezzük.
A sütőélesztőben felfedezték az ARG1 (argininoszukcinát-szintáz gén 1) transzkripcióját szabályozó ubiquitin-kötő fehérjét Rad6. Rad6 hiányában a transzkripciós faktorok és a polimeráz az ARG1 gén előtt megkötődhetnek a promóterhez (egy szabályozó DNS-szekvencia ) és megkezdhetik a transzkripciót. Rad6 jelenlétében összekapcsolja az ubiquitin molekulát a H2B hiszton alegység K123 lizinnel . Ez a H3 hiszton módosulásához vezet a szomszédos nukleoszómában: A H3 hisztont a K4 és a K49 lizinnél metilezzük. Ennek eredményeként a promotert immobilizálják, így egyetlen transzkripciós faktor sem képes megkötni. Ennek a géncsendezésnek az eredményeként az ARG1 gén már nem expresszálódik, és az argininoszukcinát szintáz enzim már nem termelődik a sejtben.
Ezenkívül a gyümölcslégyből származó H2A hiszton volt az első leírt ubiquitinált fehérje. Emlősökben a H2A és H2B hisztonok ubiquitációs állapota lett az első marker a transzkripcióval aktív kromatinnak , a DNS egészének és a hozzá tartozó fehérjéknek.
Ubiquitin a jelátvitel részeként
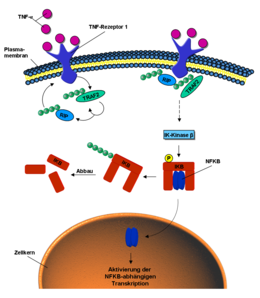
Az ubiquitin részt vesz a külső ingerek intracelluláris jelátvitelében, például az NF-kB jelátviteli útvonalban ( angl. Nukleáris faktor kappa B). Ez aktiválható a jelző molekula tumor nekrózis faktorával (TNF). Ha a TNF kötődik a sejtmembrán TNF-receptorához , akkor annak konformációs változása toborozza az E3 ligáz TRAF2-t a receptor intracelluláris részébe. Ez a poli-ubiquitinizálja önmagát és a RIP fehérjét a K63 kapcsolatokon keresztül. Az ubiquitinizált fehérjék, a RIP és a TRAF2 különböző kinázokat , foszforiláló enzimeket aktiválnak. Az IK kináz β végül foszforilezi az IKB fehérjét. Ez most felszabadítja a korábban kötött és inaktív NF-κB-t. NF-kB behatol a sejtmagba , és aktiválja a transzkripciót bizonyos gének ott. Az IkB viszont K48-on keresztül poli-ubiquitinizálódik, és a proteaszómán keresztül lebomlik.
További példák az ubikvitinációra
- Miután vége a mitózis , a ciklin részt a sejtciklus jelzett bontásban ubiquitinálás.
- A HIV -fertőzés, a sejt vírusellenes enzimek (ABOBEC3G) van összekötve egy virális HIV-fehérje (Vif). A Vif képes megkötni az ubiquitációs gépezet egyes részeit is. A Vif ezáltal az APOBEC3G-vel együtt ubiquitinizálódik és lebomlik, ami növeli a HIV-fertőzés hatékonyságát.
- A multipotens őssejtek differenciálódásában fokozott mono-ubikvitináció lép fel .
Betegségek
Az Angelman-szindróma egy neurológiai rendellenesség, amely .. lassított kognitív és motoros fejlődés révén fejezi ki magát. A leggyakoribb genetikai defektus egy 4 millió (MBP) bázispár deléció a anyai 15. kromoszómán génlókuszt q11-13. Ez a régió azonban csak a hippokampuszban és a kisagyban aktív, és többek között kódol. az E3 ubiquitin ligáz E6-AP számára. Azoknak az egereknek, akiknél nincs ez a ligáz, tanulási hiányosságok alakulnak ki, például a félelem kondicionálásában . Ezenkívül az egerek hosszú távú neuronális plaszticitása már nem adódik meg. Ezek a hiányok részben korrelálnak az Angelman-szindrómában szenvedő betegek károsodásaival.
- Hippel-Lindau dominánsan öröklődő betegségében a VHL ubiquitin ligáz génjének mutációja a transzkripciós faktor hypoxia-indukálta faktor (HIF) felhalmozódásához és a tumor kialakulásához vezet.
- A Parkin- kór bizonyos formáiban a Parkin ubiquitin ligáz mutációit azonosították .
- A Cullin7 E3 ubiquitin ligáz mutációi okozták az autoszomális - recesszív növekedési rendellenességet okozó 3-M szindrómát .
irodalom
- Roland John Mayer, Aaron J. Ciechanover, Martin Rechsteiner: Protein Degradation (= The Ubiquitin-Proteasome System and Disease , 4. kötet), Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31436-2 .
- Ebner P., GA Versteeg, F. Ikeda: Ubiquitin enzimek az immunválaszok szabályozásában. In: Kritikus áttekintések a biokémiában és a molekuláris biológiában. 52. évfolyam, 4. szám, 2017. augusztus, 425–460. O., Doi : 10.1080 / 10409238.2017.1325829 , PMID 28524749 , PMC 5490640 (ingyenes teljes szöveg) (áttekintés).
- A. Varshavsky: Az ubiquitin rendszer, az autofágia és a szabályozott fehérjebontás. In: A biokémia éves áttekintése. 86. évfolyam , 2017. június, 123–128. O. , Doi : 10.1146 / annurev-biochem-061516-044859 , PMID 28654326 (áttekintés).
- PM Lombardi, MJ Matunis, C. Wolberger : RAP80, ubiquitin és SUMO a DNS káros válaszában. In: Journal of molecular medicine. 95. évfolyam, 8. szám, 2017. augusztus, 799-807. O., Doi : 10.1007 / s00109-017-1561-1 , PMID 28681078 , PMC 5570449 (szabad teljes szöveg) (áttekintés).
Egyéni bizonyíték
- ↑ MJ Pearce, J. Mintseris és mtsai: Ubiquitin-szerű fehérje, amely részt vesz a Mycobacterium tuberculosis proteaszóma útjában. In: Tudomány. 322. évfolyam, 5904. szám, 2008. november, 1104–1107. Oldal, doi : 10.1126 / science.1163885
- ↑ JA Maupin-Furlow: Prokarióta ubiquitin-szerű fehérje-módosítás. In: A mikrobiológia éves áttekintése. 68. évfolyam , 2014., 155-175. O. , Doi : 10.1146 / annurev-micro-091313-103447
- ↑ G. Goldstein, M. Scheid, U. Hammerling, D. Schlesinger, H. Niall, E. Boyse: izolálása egy polipeptid, amely a limfocita-differenciálódási tulajdonságokat, és valószínűleg képviseli univerzálisan élő sejtekben. In: Proc Natl Acad Sci USA . 72. évfolyam, 1. szám, 1975. január, 11–5. doi: 10.1073 / pnas.72.1.11 , PMID 1078892 , PMC 432229 (szabad teljes szöveg).
- ↑ tájékoztatója a Nobel Alapítvány a 2004-es díjátadó ünnepségen a Avram Hersko és Irwin Rose (angol)
- ↑ UniProt P62988
- ↑ Cecile M. Pickart, Shahri Raasi: A poliubikvitin láncok ellenőrzött szintézise . In: Módszerek az enzimológiában . Elsevier, 2005, ISBN 978-0-12-182804-2 , pp. 21-36 , doi : 10.1016 / s0076-6879 (05) 99002-2 ( elsevier.com [hozzáférés: 2018. május 27.]).
- ^ A b C. M. Pickart, MJ Eddins: Ubiquitin: struktúrák, funkciók, mechanizmusok. In: Biochim Biophys Acta . 1695 (1-3), 2004. november 29., 55–72. PMID 15571809 .
- ↑ CM Pickart: Az ubiquitáció alapjául szolgáló mechanizmusok. In: Annu Rev Biochem . 70, 2001, 503-533. PMID 11395416 .
- C K. Cadwell, L. Coscoy: Ubiquitination nonlyzin maradványokon vírusos E3 ubiquitin ligázzal. In: Tudomány. 309 (5731), 2005. július 1., 127–130. PMID 15994556 .
- ↑ A. Ciechanover, R. Ben-Saadon: N-terminális ubiquitination: több fehérje szubsztrát csatlakozik. In: Trends Cell Biol . 14. (3), 2004. március, 103–106. PMID 15055197 .
- ↑ D. Mukhopadhyay, H. Riezman: proteaszóma-független funkció az ubiquitin endocitózis és jelzés. In: Tudomány. 315 (5809), 2007. január 12., 201-205. PMID 17218518 .
- ↑ A. Hershko, A. Ciechanover: A fehérjebontás ubiquitin rendszere. In: Annu Rev Biochem. 61, 1992, 761-807. PMID 1323239 .
- ^ H. Barriere, C. Nemes, K. Du, GL Lukacs: A polyubiquitin felismerés plaszticitása, mint lizoszómális célzási jelek az endoszomális válogató gépek által. In: Mol Biol Cell. 18. (10), 2007. október, 3952-3965. PMID 17686993 .
- ↑ CM Pickart, D. Fushman: Poliubikvitin láncok: polimer fehérjeszignálok. In: Curr Opin Chem Biol. 8 (6), 2004. december, 610-616. PMID 15556404 .
- ↑ S. Polo, S. Sigismund, M. Faretta, M. Guidi, MR Capua, G. Bossi, H. Chen, P. De Camilli, PP Di Fiore: Egyetlen motívum, amely felelős az ubiquitin felismeréséért és az monociklikinációért az endocita fehérjékben. In: Természet . 416 (6879), 2002. március 28., 451–455. PMID 11919637 .
- ↑ K. Flick, I. Ouni, JA Wohlschlegel, C. Capati, WH McDonald, JR Yates, P. Kaiser: A proteolízis-független szabályozása transzkripciós faktor Met4 egyetlen Lys 48-kapcsolt ubikvitin lánc. In: Nat Cell Biol . 6. (7), 2004. július, 634-641. Június 20. PMID 15208638 .
- ^ A b C. Esser, S. Alberti, J. Höhfeld: A molekuláris chaperonok együttműködése az ubiquitin / proteasome rendszerrel. In: Biochim Biophys Acta. 1695 (1-3), 2004. november 29., 171-188. PMID 15571814 .
- ↑ RR Kopito: A CFTR bioszintézise és lebontása. In: Physiol Rev . 79 (1 Suppl), 1999. január, 167-173. PMID 9922380 .
- ↑ CL Ward, S. Omura, RR Kopito: A CFTR lebomlása az ubiquitin- proteázóma útján. In: Cell . 83. (1), 1995. október 6., 121–127. PMID 7553863 .
- ↑ K. Robzyk, J. Recht, MA Osley: Rad6-függő ubikvitináció hiszton H2B élesztőben. In: Tudomány. 287. (5452), 2000. január 21., 501-504. PMID 10642555 .
- ↑ ZW Sun, CD Allis : A H2B hiszton ubikvitinálása szabályozza az élesztő H3 metilációját és géncsendesítését. In: Természet. 418 (6893), 2002. július 4., 104–108. PMID 12077605 .
- ↑ IL Goldknopf, H. Busch: Izopeptid-kapcsolat a nonhiszton és a hiszton 2 A kromoszomális konjugátum-protein A24 polipeptidjei között. In: Proc Natl Acad Sci USA . 74. (3), 1977. március, 864–868. PMID 265581 .
- ^ LT Hunt, MO Dayhoff : Az ubiquitin és az A24 nukleáris fehérje nem hiszton komponensének amino-terminális szekvencia azonossága. In: Biochem Biophys Res Commun . 74. (2), 1977. január 24., 650–655. PMID 836318 .
- Y SY Huang, MB Barnard, M. Xu, S. Matsui, SM Rose, WT Garrard: Az aktív immunglobulin kappa lánc gént nem ubiquitin-konjugált nukleoszómák csomagolják. In: Proc Natl Acad Sci U.S.A. 83 (11), 1986. június, 3738-3742. PMID 3012532 .
- Kar M. Karin, Y. Ben-Neriah: A foszforilezés találkozik az ubiquitációval: az NF- [kappa] B aktivitás szabályozásával. In: Annu Rev Immunol . 18, 2000, 621-663. PMID 10837071 .
- ^ E. Meylan, J. Tschopp: A RIP-kinázok: a sejtes stressz döntő integrátorai. In: Trends Biochem Sci . 30. (3), 2005. március, 151-159. PMID 15752987 .
- ^ TD Gilmore: Bevezetés az NF-kappaB-be: játékosok, utak, perspektívák. In: Onkogén . 25 (51), 2006. október 30., 6680-6884. PMID 17072321 .
- ↑ M. Magnani, R. Crinelli, M. Bianchi, A. Antonelli: Az ubiquitin-függő proteolitikus rendszer és egyéb potenciális célpontok a moduláció a nukleáris faktor-kB (NF-kB). In: Curr drogcélok . 1. (4), 2000. december, 387-399. PMID 11467077 .
- ^ F. Bassermann, C. von Klitzing, S. Münch, RY Bai, H. Kawaguchi, SW Morris, C. Peschel, J. Duyster: A NIPA meghatároz egy SCF típusú emlős E3 ligázt, amely szabályozza a mitotikus belépést. In: Cell. 122. (1), 2005. július 15, 45–57. PMID 16009132 .
- ^ Y. Dang, LM Siew, YH Zheng: Az APOBEC3G-t a proteazomális útvonal Vif-függő módon lebontja anélkül, hogy poliubikvitilálná. In: J Biol Chem . 2008. március 6. PMID 18326044 .
- ↑ O. Karpiuk, Z. Najafova, F. Kramer, M. Hennion, C. Galonsk, A. König, N. Snaidero, T. Vogel, TA Shchebet, Y. Begus-Nahrmann, M. Kassem, M. Simons, H. Shcherbata, T. Beissbarth, SA Johnsen: A hiszton H2B monoubiquitination szabályozó útvonalra van szükség a multipotens őssejtek differenciálódásához. In: Molecular Cell. 46 (5), 2002, 705-713.
- ↑ E. Weeber, J. Levenson, J. Sweatt: Az emberi megismerés molekuláris genetikája . In: Mol Interv . szalag 2 , nincs. 2002., 6. o. 376-391, 339 , doi : 10.1124 / mi.2.6.376 , PMID 14993414 .
- ↑ H. Shimura, N. Hattori, S. Kubo, Y. Mizuno, S. Asakawa, S. Minoshima, N. Shimizu, K. Iwai, T. Chiba, K. Tanaka, T. Suzuki: Családi Parkinson-kór géntermék A parkin egy ubiquitin fehérje ligáz. In: Nat Genet . 25. (3), 2000. július, 302–305. PMID 10888878 .
- ↑ C. Huber, D. Dias-Santagata, A. Glaser, J. O'Sullivan, R. Brauner, K. Wu, X. Xu, K. Pearce, R. Wang, ML Uzielli, N. Dagoneau, W. Chemaitilly, A. Superti-Furga, H. Dos Santos, A. Mégarbané, G. Morin, G. Gillessen-Kaesbach, R. Hennekam, I. Van der Burgt, GC Black, PE Clayton, A. Read, M. Le Merrer, PJ Scambler, A. Munnich, ZQ Pan, R. Winter, V. Cormier-Daire: A mutációk azonosítása a CUL7-ben 3-M szindrómában. In: Nat Genet. 37 (10), 2005. október, 1119-1124. PMID 16142236 .
web Linkek
- Az ubiquitin rendszer a fehérje módosítására és lebontására. Információ az ubiquitin-ről a Nottingham Egyetemen.
- Jennifer McDowall: Ubiquitin. (Angol).