inzulin
| inzulin | ||
|---|---|---|

| ||
| Az inzulin molekula két modell -ábrázolása. A bal oldalon az egyszerű molekula (monomer), mint kupola modell , amelyből a felszín alakja kirajzolódik. Jobb oldalon a hatszoros molekula (hexamer), úgynevezett szalagmodell , amelyben a belső szerkezet világossá válik. Ez utóbbi esetben az α-hélixeket csavarok, a β-lapokat nyilak jelölik . | ||
|
Meglévő szerkezeti adatok : 1ai0 , 3in , 4ins , 6ins , 7ins , 9ins | ||
| Az emberi fehérje tulajdonságai | ||
| Tömeg / hossz elsődleges szerkezet | 5,8 kDa / 51 aminosav | |
| Másodlagos a negyedéves szerkezethez | Heterodimer (21 + 30 aa) | |
| Prekurzor | Proinzulin | |
| Azonosító | ||
| Gén neve | BELE | |
| Külső azonosítók | ||
| Gyógyszerinformációk | ||
| ATC kód | A10 AB01 | |
| DrugBank | DB00030 | |
| Esemény | ||
| Homológia család | CLU_140421_1_0 | |
| Szülő taxon | Gerincesek | |
| Ortológus | ||
| személy | egér | |
| Entrez | 3630 | 16334 |
| Együttes | ENSG00000129965 | ENSMUSG00000000215 |
| UniProt | P01308 | Q5EEX1 |
| Refseq (mRNS) | NM_000207 | NM_008387 |
| Refseq (fehérje) | NP_000198 | NP_032413 |
| Génlókusz | Kr. 11: 2,14 - 2,14 Mb | Chr 7: 142,49 - 142,49 Mb |
| PubMed keresés | 3630 |
16334
|
Inzulin (más nevek: insulinum , inzulin hormon , szigetsejt hormon ) egy proteohormon (polipeptid hormon ), amely alapvető fontosságú az összes gerincesek és van kialakítva a β -sejtek az a hasnyálmirigy . Ezek a speciális cellák a Langerhans -szigeteken találhatók . A név „inzulin” származik ezeket a szigeteket (a latin insula „sziget”). Az inzulin részt vesz az anyagcsere szabályozásában, különösen a szénhidrátoké. Az inzulin csökkenti a vércukorszintet azáltal, hogy stimulálja a szervezet sejtjeit a glükóz felvételére a vérből .
Funkció és hatás
A vér glükózkoncentrációját egy szabályozó áramkör szabályozza, amely két hormonból áll, amelyek a vércukorszinttől függően szabadulnak fel. Az inzulin az egyetlen hormon , amely csökkentheti a vércukorszintet. Antagonistája a glukagon , amelynek fő feladata a vércukorszint növelése. Még az adrenalinnak , a kortizolnak és a pajzsmirigyhormonoknak is van glükózfokozó hatása.
A vércukorszint különösen a szénhidrátban gazdag ételek fogyasztása után emelkedik . Válaszul a β -sejtek inzulint bocsátanak ki a vérbe . Az inzulin csökkenti a vércukorszintet azáltal, hogy a glükóz a vérplazma és a szöveti folyadék áthaladjon a sejtmembránon át a belsejébe a sejt segítségével a „kulcs funkció” . Különösen a máj és az izomsejtek képesek rövid idő alatt nagy mennyiségű glükózt felvenni, és glikogén formájában tárolni , vagy lebontani az energiatermelés érdekében (lásd glikolízis ).
A hormon más sejteket is érint, ezért hatással van a zsír- és aminosav -anyagcserére , valamint a kálium -egyensúlyra .
A hormon elengedhetetlen tényező a következő betegségekben:
A vérben keringő inzulin úgy működik, hogy kötődik az inzulin receptorokhoz.
Inzulin receptor
Végső soron, a kötési e hormon triggerek annak receptor számos kináz - kaszkádok (kaszkád foszforiláció a) átmenő jelutak lehet leírni.
Ezek a jelátviteli utak a vércukorszint csökkenését okozzák
- A glükózfelvétel elősegítése ( GLUT4 - transzlokáció a sejtfelszínre)
- Elősegíti a glükóz tárolását ( glikogén szintézisét ) a májban és az izmokban
Ezt a jelet támogatja a glükózfogyasztó utak aktiválása. További támogató intézkedések közé tartozik a glükózszállító utak elnyomása, például a második hírvivő cAMP lebontásával egy foszfodiészterázon keresztül .
Glükózfelvétel az izomszövetben
A hormon növeli a sejtmembrán permeabilitását (permeabilitását) a glükóz számára az izmokban és a zsírszövetekben . Meg kell jegyezni, hogy nem maga a membrán válik áteresztőbbé, hanem több glükóz hordozófehérje aktiválódik. Ez a hordozófehérje a GLUT4, egy nagy affinitású, inzulinfüggő glükóz transzporter , amely a glükózt a sejtbe szállítja megkönnyített diffúzióval (passzív transzport). A GLUT4 esetében a következő fizikai tulajdonságok relevánsak: telíthető , nem aktiválható vagy inaktiválható, azaz szabályozás csak inzulinfüggő beépítéssel vagy expanzióval.
Glükózfelvétel és anyagcsere az agyban
Az idegsejtek (és az eritrociták ) glükóz-inzulint szednek- attól függ. Ezért, ha az inzulinszint emelkedik, az inzulinfüggő sejtek több glükózt vesznek fel, és kevesebb marad az inzulin-független sejtek számára.
Általában fennáll a glükózfüggő idegrendszer károsodásának kockázata hipoglikémiával . A központi idegrendszerrel közvetlenül érintkező orrspray -ként adott inzulint az Alzheimer -kór kezelésére tanulmányozzák .
A zsírszövet felépülése és lebomlása
A hormon gátolja a zsírszövet lipolízisét és ezáltal a zsírbontást . Az inzulinhiány ezért fokozott lipolízishez vezet, keto testek kialakulásával és az ebből eredő ketózissal .
A sejtnövekedés elősegítése
A peptid hormon inzulin másik központi funkciója a sejtek növekedésének és proliferációjának szabályozása azáltal, hogy aktiválja azokat a géneket, amelyek nagy jelentőséggel bírnak a sejtciklus szabályozása és lefolyása szempontjából. Ez az inzulinhatás kérdés az inzulin készítményekről folytatott megbeszélések során .
A triptofán felvétele az agyban
A magasabb inzulinszint némileg növeli a triptofán felszívódását az agyban.
Az inzulin és a vércukorszint szabályozása
Az inzulin egyik legfontosabb biológiai hatása a glükózfelvétel gyors felgyorsulása az izom- és zsírsejtekben, valamint a májban a köztes tárolás szabályozása a vércukorszint szabályozásának részeként :
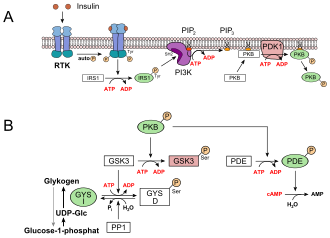
- A szénhidrátok elfogyasztott étel tárolják a glikogén a májban és az izmokban . Ez a vér glükózkoncentrációjának csökkenéséhez vezet . A glükóz felvétel a májsejtekben az inzulintól függetlenül történik a GLUT2 -n keresztül. A receptor tirozin -kinázt (RTK) inzulin aktiválja, amely megindítja a jelátvitelt. Az 1. inzulinreceptor- szubsztrát (IRS1), a foszfoinozitid-3-kináz (PI3K), a második hírvivő foszfatidil-inozitol-4,5-biszfoszfát (PIP 2 ), a foszfoinozitid-függő kináz-1 (PDK1) és végül a protein-kináz részt vett B (PKB) (lásd az A képet). A PKB foszforilálja a glikogén -szintáz -kináz 3 -at, a GSK3 -at, amely ezáltal inaktiválódik. A GSK3 egy kináz, amely foszforilálja a glikogén szintetázt, és ezáltal inaktiválja azt (GYS b ). A GSK3 verseng a foszfatázzal , a fehérje -foszfatázzal 1 (PP1). Mivel a GSK3 már nem tud működni, egyre több a glikogén szintáz a defoszforilált formájában (GYS a , lásd az alábbi képet, B). A PKB egy foszfodiészterázt, PDE -t is aktivál, amely a cAMP -t AMP -vé hidrolizálja. Ennek eredményeképpen a glikogén lebontásáért felelős protein -kináz A jelútja is elvész.
- Az inzulin hatására a máj, a zsírszövet és az izmok stimulálják a triglicerid szintézist . Ennek szubsztrátjai a szénhidrátok mellett az étellel bevitt lipidek .
- Az említett három szövetben az aminosavak egyre jobban felszívódnak, és fehérjeszintézisre használják őket.
Az inzulin metabolikus és mitogén hatásait a célszövetek máj, izom és zsír sejtfelszínén lévő receptorához való kötődés indítja el.
- Az inzulin továbbá glikogén szintézist és tárolást indukál a májban és az izmokban, triglicerid szintézist a májban és a zsírszövetben, valamint az aminosavak tárolását az izmokban.
- Ugyanakkor az inzulin gátolja a máj glükoneogenezisét, és ezért a glükóz metabolizmus egyik legfontosabb szabályozója .
Ellenfél
Ha a vércukorszint a szervezetben 80 mg / dl érték alá csökken, az inzulin termelés már jelentősen csökken.
Ha a vércukorszint tovább csökken, az inzulin különböző ellenfelei jelennek meg:
Ezen ellenszabályozó hormonok szintje jelentősen emelkedik, ha a vércukorszint 60 mg / dl alá csökken.
Az 1-es típusú cukorbetegségben az ellenszabályozó mechanizmus is gyakran megzavarodik, ami további problémákhoz vezet a hipoglikémiával kapcsolatban .
A szomatosztatin gátló hatást fejt ki az inzulin és a glukagon szekréciójára, mivel általános gátlóként működik a szervezetben.
Hatás a káliumszintre
Az inzulin csökkenti a kálium-szintet a vérben annak biztosításával, hogy a kálium eltolódott belsejébe hepatociták és vázizom sejtek , azaz a sejten kívüli és sejten belüli . Ez a nátrium-kálium-ATPáz inzulinnal történő aktiválásával történik . Az inzulin készítményeket ezért glükózzal együtt alkalmazzák (a hipoglikémia megelőzésére ) a hiperkalémia kezelésére .
Esemény
Több mint 100 különböző faj inzulinszekvenciája ismert. Az egyes inzulinok fehérjeszekvenciái hasonlóak - szekvenciahomológiát mutatnak -, de nem azonosak. Az emberi inzulin kémiai szerkezetének különbségeiről egyes emlősök inzulinjaihoz képest, valamint a mesterségesen előállított inzulinról szóló információkat lásd az inzulin készítményben .
Inzulin és evolúció : Azok a genotípusok, amelyek megakadályozták az energiatartalékok gyors kimerülését a vadászó-gyűjtögető társadalmakban, amikor élelemhiány volt, hajlamosak az elhízásra és a 2-es típusú cukorbetegségre a mai életmódban, a mozgáshiány és a túlzott élelem miatt .
Az, hogy a gének milyen mértékben befolyásolják a glükóz anyagcserét és az inzulin kapcsolódó hatásait, még nem teljesen tisztázottak.
Az inzulin homológjai a rovarokban a Drosophila inzulinszerű peptidek .
Oktatás, tárolás, kiadás és szabályozás
bioszintézis
A hormon a hasnyálmirigy Langerhans -szigeteinek β -sejtjeiben szintetizálódik . A genetikai információ által kódolt egyetlen génlókusz rövid karján a 11. kromoszóma . A gén körülbelül 300 nukleotidból áll .
Az mRNS-t először fordították át preproinzulin , amely 110 aminosavból, a riboszómák található a durva endoplazmatikus retikulum (ER) .
A további feldolgozás történik két lépésben, miután a hajtogatását a molekula által a kialakulását diszulfid hidak , az inzulin molekula képződik lehasítjuk az szignálpeptidet és a C-peptid.
|
tárolás
Az inzulin molekulák a hólyagocskák a Golgi-készülék található, amely a sejt membránján β-sejtek cink - ionok a hexamerek kötött és tárolja, hogy stabilizált (cink-inzulin komplex).
Az inzulin molekulák cinkkötő képességének számos fontos hatása van. Az inzulin nem hatásos formában hexamerjeinek után összeomlanak a dimerek , de csak egyetlen molekula. Ez a tulajdonság fontos szerepet játszik az inzulin készítményekben . Gyors hatású inzulin készítmények esetében a molekuláris összeállítások lassú szétesése nem kívánatos, és lehetőségeket keresnek a szétesés felgyorsítására. Hosszú hatású inzulinkészítmények esetében a cink kötődését kifejezetten erősíti a magas cinkkoncentráció a hatás időtartamának meghosszabbítása érdekében . Az orális inzulin készítmények kifejlesztésekor a cinkkötést az inzulin molekulák szállítására történő összekapcsolására használják.
terjesztés

Az inzulin felszabadulása a vérbe exocitózison keresztül történik .
Az inzulin oszcilláló módon szabadul fel . Az inzulin három -hat percenként kerül a véráramba . Az étkezést követően az anyagcserében egészséges egyének kétfázisú inzulinszekréciót mutatnak: az első „inzulincsúcs ” három -öt perc múlva csúcsosodik ki, és tíz percig tart. Ezt követi egy második fázis, amely mindaddig tart, amíg a hiperglikémia fennáll. Az első fázis a tárolt inzulinmolekulákból áll, a második fázis főleg az újonnan képződött inzulinból.
A C-peptidet csak akkor vágják ki a proinzulinból a peptidázok, ha a vércukorszint emelkedik, és felszabadul az aktív inzulinnal és cinkkel együtt. A szérumban található C-peptid kimutatásával mérhető az endogén inzulin termelés. A cukorbetegek esetében például kijelenthető, hogy mennyi inzulint termel még a szervezet maga, mivel a szintetikus termék nem tartalmaz C -szekvenciát.
szabályozás
Az inzulin fő feladata a glukagonnal együtt, hogy bizonyos értékek között folyamatosan tartsa a vércukorszintet. Ha a vércukorszint egy bizonyos érték alá esik, fennáll a hipoglikémiás kóma és a halál kockázata, ha egy bizonyos szint fölé emelkedik, akkor fennáll a véredények, a vesesejtek és más szövetek károsodásának veszélye. A leptinnel együtt azonban úgy tűnik , hogy az inzulinnak is jelentős szerepe van az energia -homeosztázisban . A leptin nemcsak az inzulinra hat, hanem maga az inzulin is hat a leptinre, pontosabban a leptin agyi felszívódására.
Létfontosságú funkciója miatt a vezérlőhurok biokémiai megvalósításának robusztusnak kell lennie. Mivel a sejtek nem tudnak „gondolkodni”, csak az lehet, hogy az egyes sejtek úgy működnek, mint egy állapotgép, vagy hogy kevés sejt működik együtt úgy, hogy az inger értelmesen kiszámítható legyen.
Az inzulin β-sejtből történő felszabadulásának fő ingere a vércukorszint (5 mmol glükóz / l vérből), és ezt közvetlenül a β-sejt "méri". Ezt biokémiai úton valósítják meg ATP -szabályozott káliumcsatornák stb. Segítségével, lásd #glükóz -szabályozott felszabadulási mechanizmus .
A gasztrin , szekretin , GIP és GLP-1 hormonok módosítják az alapvető glükóz-inzulin szabályozó áramkört azáltal, hogy hatnak a β-sejtre. Lásd a növekvő hatást .
GIP van a vérbe által K-sejtek , amelyek található a nyálkahártya a duodenum , és „intézkedés” a glükóz a gyomorpép , és növeli az inzulin felszabadulását a β-sejtek. A GIP tehát egy olyan időpontban hat a β -sejtekre, amikor az élelmiszerből származó glükóz még nem érte el a vért.
A GLP-1- et L-sejtek választják ki a vérbe , amelyek az ileum és a vakbél nyálkahártyájában helyezkednek el, és „mérik” a chyme-ban lévő glükózt, és növelik a p-sejtek inzulin felszabadulását is. A legtöbb tápanyagot a jejunumban vonják ki, és a vérbe vagy a nyirokba engedik. A cecumban nem felszívódik a tápanyagok, hanem elsősorban az erjedés.
Ezenkívül a β -sejteket a paraszimpatikus és a szimpatikus idegrendszer is beidegzi:
A paraszimpatikus NS leptin elégtelenség esetén aktiválódik (vagy leptinrezisztencia esetén is), és általában trofotróp hatású, azaz vagyis energiát tárol. Tehát növeli az inzulinszállítást. Legalábbis egerekben egyidejűleg hat a zsírsejtekre is, és növeli azok érzékenységét az inzulinra, miközben a máj- és izomsejtek érzékenysége nincs hatással. A glükóz beépül a glikogénbe a májban és az izomsejtekben, és így tárolódik; de novo lipogenezis és a TG -k tárolása az adipocitákban történik.
A szimpatikus NS leptin -elégtelenségben aktiválódik, és általános ergotrop hatása van, azaz. vagyis növeli az energiafogyasztást. Csökkenti az inzulinszállítást. Úgy tűnik, hogy az inzulin felszabadulásának csökkentése ellensúlyozza a megnövekedett energiafogyasztást, mivel az izomsejtek sokkal több glükózt tudnak felvenni a vérből, ha a lehető legtöbb GLUT-4 transzporter van a felszínen. Tehát vissza kell esnie a már tárolt energiára glikogén és zsírsavak formájában.
Glükózvezérelt felszabadító mechanizmus

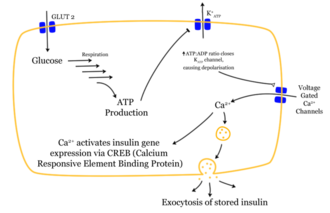
A glükózmolekula behatolása a β-sejtbe hatások láncát indítja el. Miután a glükóz a GLUT1 transzporteren keresztül bejutott a sejtbe, glikolízissel metabolizálódik . A kapott ATP gátolja a kiáramlás a kálium- ionok ( ATP-érzékeny káliumcsatornák ). A nagymértékben csökkent kálium -kiáramlás depolarizációhoz vezet , mivel a membránpotenciál stabilitását már nem tartja fenn a kálium -kiáramlás. A depolarizált membránpotenciál feszültségfüggő kalciumcsatornákat okoz . A kalciumionok beáramlása a döntő inger az inzulint tartalmazó vezikulák és a sejtmembrán közötti fúzióhoz .
A tárolt inzulin molekulák felszabadulnak a membránok ( exocitózis ) összeolvasztásával a β -sejtekből az extracelluláris térbe és tovább a véráramba. A tárolóhexamereket elkülönítik. Az inzulin szintje emelkedik a vérben.
Felezési idő és degradáció
Az egyes inzulin molekulák biológiai felezési ideje a véráramban körülbelül öt perc.
Az inzulin néhány inzulinreceptoron keresztül felszívódik a sejtekbe, ahol lebomlik és így elhasználódik. A májban és a vesékben az inzulint inzulináz inaktiválja; az inzulináz, pontosabban a glutation-inzulin transzhidrogenáz felosztja az A- és B- lánc közötti diszulfidhidakat , ezáltal az inzulin két részre oszlik, és hatástalanná válik. A bomlástermékeket a vesék választják ki, valamint a még ép inzulin 1,5% -át. Az inzulin aktivitásának rövid időtartama azt mutatja, hogy a cukor -anyagcsere fiziológiai szabályozása nagyon gyorsan működik az egészséges szervezetben; ez a sebesség gyakorlatilag nem érhető el a diabetes mellitus kezelésében .
Az inzulin, mint gyógyszer

Az inzulinterápia során különböző inzulinkészítményeket használnak. A leggyakoribb és legrégebbi beadási módszer a szubkután injekció . Erre a célra számos rövid, közepes és hosszú hatású humán inzulin és inzulinanalóg áll rendelkezésre. Ha ezeket terápiára kombinálják, különös figyelmet kell fordítani a különböző felezési időkre .
- nagyon gyors és rövid hatású: glulizin inzulin, lispro inzulin, aszpart inzulin
- rövid hatású: normál inzulin (= oldott humán inzulin)
- Közepes hatású: NPH inzulin , kétfázisú lispro inzulin, kétfázisú aszpart inzulin
- hosszú hatású: a detemir inzulin , inzulin glargin inzulin degludec
A perorális inzulin hatástalan, mivel a szervezet enzimeinek gyomor -bél traktusában lévő fehérje láncok lebomlanak, mielőtt hatni tudnak. Azt vizsgálják, hogy az inzulinokat milyen mértékben lehet kapszulázni nanorészecskékbe, hogy ilyen módon "emésztetlenül" jussanak be a véráramba. Az újabb fejlemények, mint például az inhalációs készítmények , amelyek inzulint juttatnak a légutakon keresztül, eddig nem tudták megállni a helyüket a piacon.
A múltban az inzulint az inzulin sokk terápia részeként használták mentális betegségben szenvedők kezelésére . Ezt a kezelési módot mutatta be például az A Beautiful Mind to John Nash című életrajzi film . Ezt az eljárást már nem gyakorolják.
Az inzulinnal való visszaélés
Az inzulin azért szerepel a tiltott doppingszerek listáján, mert több célra is felhasználható. Mivel az inzulin ellensúlyozza a szomatropin által okozott csökkent glükózfelvételt az izomsejtekben, gyakran használják nemkívánatos mellékhatásainak kompenzálására (lásd anabolikus szteroidok ). Egyéb felhasználási területek közé tartozik a glikogén utánpótlás elősegítése az állóképességi sportolókban és az izomtömeg felépítésének elősegítése.
Az inzulin nem megfelelő önbeadása a vércukorszint túlzott csökkentése érdekében a hypoglykaemia factitia klinikai képéhez vezet .
2008 márciusában, a Newcastle nővér Colin Norris ítélték 30 év börtönre ítélték, mert megölte négy betegének befecskendezésével nagy dózisú inzulint.
Idővonal a kutatás történetéhez
| 1869 | Paul Langerhans felfedezte a szigetsejteket a hasnyálmirigy szövetében. |
| 1889 | Oskar Minkowski és Josef von Mering eltávolították a hasnyálmirigyet a kutyáktól, és ezáltal cukorbetegséget okoztak. Röviddel ezután a szigetsejtek feltételezhetően endokrin (hormontermelő) szövetek voltak. |
| 1894 | Eugene Gley (1857–1930) francia fiziológus és endokrinológus egy levágott állat hasnyálmirigy -kivonatával csökkentette a hasnyálmirigy -eltávolított kutya vércukorszintjét. Különbséget tett az exokrin és az endokrin funkció között, és az utóbbit a szigetsejtekhez rendelte. |
| 1906 | 1906. június 21 -én Georg Ludwig Zülzer német belgyógyász professzor először injekciót hajtott végre az embereken az acomatol nevű borjú hasnyálmirigy -kivonattal, amelyet a Schering cég izolált és előállított. |
| 1909 | Az " inzulin " kifejezés , amely "a szigetekről származik", először jelent meg . Jean de Meyer (1878–1934) belga patológus javasolta az „inzulin” elnevezést, amely a latin „insula” -ból származik az eddig ismeretlen anyaghoz. |
| 1910 | Edward Albert Sharpey-Schafer angol fiziológus "inzulin" -nak nevezte a cukorbetegeknél hiányzó hasnyálmirigyből származó anyagot. A rendelkezésre álló forrásokból nem derül ki, hogy ki találta ki először a nevet. |
| 1916 | Nicolae Paulescu sikerült először a megszerzése inzulinnak a hasnyálmirigy szövetet. |
| 1921 | követte Frederick Banting és Charles Best , az inzulin izolálását az állati magzatok hasnyálmirigyéből, "szigeteknek" nevezték. |
| 1922 | Sikeres alkalmazás betegeknél és az ipari inzulingyártás megkezdése Kanadában |
| 1923 | Frederick Banting és John James Rickard Macleod fiziológiai vagy orvosi Nobel -díjat kapott az inzulin felfedezéséért. |
| 1926 | Az inzulin kristályosított ábrázolása John Jacob Abel Amerikában |
| 1928 | Oskar Wintersteinernek sikerült bebizonyítania, hogy az inzulin fehérje. |
| 1958 | A kémiai Nobel-díjat ment Frederick Sanger munkájáért a fehérjék szerkezete, különösen az inzulin . |
| 1963 | Helmut Zahn professzornak és csapatának sikerült a világ első inzulin kémiai szintézise. |
| 1964 | A kémiai Nobel-díjat ment Dorothy Hodgkin neki meghatározására biokémiai szerkezete fontos anyagok, mint például az inzulin és a B-vitamin 12, az X-ray struktúra elemzése . |
| 1971 | az inzulin háromdimenziós fehérjeszerkezetét Blundell et al. felvilágosult. |
| 1982 | először sikerült nagy mennyiségű humán inzulint előállítani géntechnológiával módosított baktériumok felhasználásával. |
| 1996 | A lispro inzulin ( Humalog kereskedelmi név ) volt az első gyors hatású inzulinanalóg. |
| 2000 | A glargin inzulin ( Lantus kereskedelmi név ) volt az első hosszú hatású inzulinanalóg. |
| 2015 | az Abasaglar (glargin inzulin) az első bioszimiláris inzulin a piacon. |
web Linkek
Egyéni bizonyíték
- ^ Mátyás Ottó: Analitikai kémia. John Wiley & Sons, 2011, ISBN 978-3-527-32881-9 , 557. o.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biokémia. 6. kiadás. Spektrum-Verlag, 2007, ISBN 978-3-8274-1800-5 .
- ↑ S. Craft, LD Baker, TJ Montine et al. : Intranazális inzulinterápia Alzheimer -kór és enyhe kognitív károsodás esetén: kísérleti klinikai vizsgálat . In: Neurológiai Archívum . szalag 69 , nem. 1 , 2012. január p. 29–38 , doi : 10.1001 / archneurol.2011.233 .
- ^ PM Daniel, ER Love, SR Moorhouse, OE Pratt: Az inzulin hatása a triptofán beáramlására a nyúl agyába. In: J Physiol . 312. kötet, 1981. március, 551-562. O., Doi: 10.1113 / jphysiol.1981.sp013643
- ↑ "Drágám, a kálium 7,2 mmol / l". (PDF) Letöltve: 2018. október 6 (előadás a bécsi orvosi egyetemen).
- ↑ Így van az emberrel , a csimpánzzal , az egérrel , a nyúllal és a zebrahallal is : hasonló, de nem azonos inzulinfajták egymáshoz igazítása .
- ^ J. Vander Molen, LM Frisse, SM Fullerton, Y. Qian, L. Del Bosque-Plata, RR Hudson, A. Di Rienzo: CAPN10 és GPR35 populációgenetikája: következmények a 2-es típusú cukorbetegség változatainak fejlődésére. In: American Journal of Human Genetics . 76. évfolyam, 4. szám, 2005. április, 548-560. O., Doi: 10.1086 / 428784 . PMID 15696418 , PMC 1199293 (ingyenes teljes szöveg).
- ↑ A gének befolyásolják a glükóz anyagcserét. (Már nem érhető el online.) In: aerzteblatt.de . 2010. január 18, archiválva az eredetiből 2015. november 26 -án ; Letöltve: 2015. november 25 .
- ↑ Bejegyzés az inzulinról a Flexikonban , a DocCheck cég wikijében , hozzáférhető 2015. november 25 -én.
- ↑ David Owerbach, Graeme I. Bell, William J. Rutter , Thomas B. Mutatja: Az inzulin gén emberek 11. kromoszómáján található. In: Természet . 286, 1980, 82. o., Doi: 10.1038 / 286082a0 .
- ↑ UniProt P01308
- ↑ UniProt bejegyzés
- ↑ a b Helmut Schatz (szerk.): Diabetology compact. 4. kiadás. 2006, ISBN 3-13-137724-0 .
- ↑ Heiner Laube: Inzulinrezisztencia . Patofiziológia , terápia és perspektívák . Uni-Med, 2001, ISBN 3-89599-541-X .
- ↑ Florian Horn: Humán biokémia: az orvosi tanulmányok tankönyve . 5. kiadás. Thieme, Stuttgart 2012, ISBN 978-3-13-130885-6 , p. 351 .
- ↑ Mark E Daly: Akut hatás a magas szacharóztartalmú inzulinérzékenységre és a napi anyagcsere-profilokra a keményítőtartalmú étrendhez képest . In: Am J Clin Nutr . Nem. 67 , 1998, pp. 1186–1196 (angol, ajcn.org [PDF; hozzáférés: 2011. február 19.]).
- ↑ Előadás jegyzetek Biokémia 2 . Orvostanhallgató a Müncheni Egyetemen; archive.org
- ^ Hager kézikönyve a gyógyszerészeti gyakorlatról. P. 552.
- ↑ Yu-Hsin Lin és munkatársai: Kitozánnal burkolt nanorészecskék előkészítése és jellemzése az orális inzulinszállításhoz. In: Biomakromolekulák . 8 (1), 2007, 146-152. doi: 10.1021 / bm0607776
- ↑ WADA: A tiltott lista 2007 ( Memento 2014. április 21 -től az Internet Archívumban ) (PDF; 125 kB)
- ↑ Doppinghírek: inzulin ( Memento 2007. június 7 -től az Internet Archívumban )
- ↑ Tom Chivers: Colin Norris, a halál angyala nővér, elítélték. In: The Telegraph . 2008. március 2., hozzáférés: 2016. szeptember 6 .
- ↑ Jacek Zajac, Anil Shrestha, Parini Patel, Leonid Poretsky: A Diabetes Mellitus elvei . Szerk .: Leonid Poretsky. Springer US, New York 2010, ISBN 978-0-387-09840-1 , fejezet A főbb események a cukorbetegség történetében , pp. 3–16 , doi : 10.1007 / 978-0-387-09841-8_1 ( friedmanfellows.com [PDF]).
- ↑ Vivienne Baillie Gerritsen: A 20. századi fehérje . In: Fehérje reflektorfény. 2001. április 9.
- ↑ Helmut Zahn, Johannes Meienhofen, Dietrich Brandenburg et al.: Az inzulinláncok szintézise és ezek kombinációja inzulin-aktív készítmények előállításához. In: Journal of Nature Research B . 18, 1963, 1120-1121 ( online ).
- ↑ TL Blundell, JF Cutfield, SM Cutfield et sl. : Atomi pozíciók romboéderes 2-cink inzulin kristályokban . In: Természet . szalag 231 , nem. 5304 , 1971. június, p. 506-511 , PMID 4932997 .