Foszfor -pentoxid
| Szerkezeti képlet | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Tábornok | ||||||||||||||||
| Vezetéknév | Foszfor -pentoxid | |||||||||||||||
| más nevek |
|
|||||||||||||||
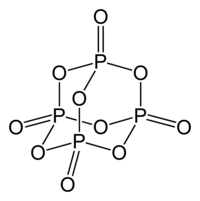
| Molekuláris képlet | P 4 O 10 | |||||||||||||||
| Rövid leírás |
színtelen, szagtalan, nedvszívó szilárd anyag |
|||||||||||||||
| Külső azonosítók / adatbázisok | ||||||||||||||||
| ||||||||||||||||
| tulajdonságait | ||||||||||||||||
| Moláris tömeg | 283,92 g mol -1 | |||||||||||||||
| Fizikai állapot |
rögzített |
|||||||||||||||
| sűrűség |
|
|||||||||||||||
| Olvadáspont |
|
|||||||||||||||
| Szublimációs pont |
362 ° C (normál nyomáson) |
|||||||||||||||
| oldhatóság |
vízzel bomlik foszforsavvá |
|||||||||||||||
| biztonsági utasítások | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Amennyire lehetséges és szokásos, SI egységeket használnak. Eltérő rendelkezés hiányában a megadott adatok a szabványos feltételekre vonatkoznak . | ||||||||||||||||
Foszfor-pentoxid , pontosabban difoszfor-pentoxid , egy -oxid az elem foszfor és tartozik az anyag csoportját foszfor-oxidok . Ez egy színtelen, szagtalan, rendkívül higroszkópos por, amelyet vízzel erősen exoterm reakcióban foszforsavvá alakítanak át .
Bár régóta ismert, hogy a molekula a P 4 O 10 empirikus képlettel írható le, a történelmi név (di) foszfor -pentoxid , azaz P 2 O 5 (CAS -szám1314-56-3 ), megőrizték.
Gyártás
A foszfor -pentoxid akkor keletkezik, amikor a fehér foszfort száraz levegőáramban égetik , erős hőfejlődéssel:
Oxigénhiány esetén P 4 O 6 foszfor -trioxid is képződik , amelyben a négy „külső” oxigénatom (a fenti képletben kettős kötésű foszforatomhoz) hiányzik.
tulajdonságait
Fizikai tulajdonságok
A foszfor -pentoxid szublimál 362 ° C -on , az olvadáspont csak 562 ° C -on határozható meg nyomás alatt, zárt ampullában.
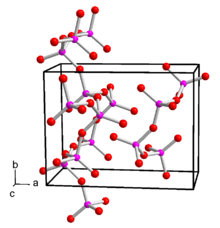
A foszfor -pentoxid polimorf . A hatszögletű H alak átalakítása 450 ° C-on, nyomás alatt, 24 óra alatt folyik a folyadék- és üvegfázison keresztül az ortorombikus O alakúra, majd tovább a stabil, hasonlóan az ortorombikus O'alakúra. A rombos forma, amely stabil szobahőmérsékleten, kristályosodik a tércsoport Pnma (tércsoport nélkül. 62) , és a rács paramétereit egy = 9,193 Á, b = 4,89 Á és c = 7,162 Á. Ez végtelen rétegekből áll, amelyek hat PO 4 tetraéder gyűrűből állnak . Van egy metastabil trigonális szerkezet is, ahol az R 3 c tércsoport (161. sz.) És a rácsparaméterek a = 10,2 Å és c = 13,5 Å. Ez izolált P 4 O 10 molekulákból áll. Létezik az o-forma is, amely nem izolált molekulákból áll, hanem PO 4- tetraéder láncaiból, amelyeket három oxigénatom köt össze . Ez az alakzat is ortorombikus, Fdd 2 tércsoport (43. szám) , a rácsparaméterekkel a = 16,31 Å, b = 8,155 Å és c = 5,265 Å. P 4 O 10 molekulák vannak jelen a gázfázisban . Elektrondiffrakció segítségével a P = O kettős kötés kötéshossza 143 pm, a PO egyes kötés 160 pm lehet. A kötési szögek 123,5 ° POP, 116,5 ° O = PO és 101,6 ° OPO esetén.
Kémiai tulajdonságok
A foszfor -pentoxid nagy hajlamú a víz felszívására és a tetrametafoszforsav képződésére :
Az egyensúly szinte teljesen a jobb oldalon van, így foszfor-pentoxidot tartalmazó zárt térben 1,3 · 10–4 Pa alatti vízgőznyomás alakul ki .
A víz további felszívódása a legegyszerűbb polifoszforsavhoz, a difoszforsavhoz vezet
hogy ortofoszforsavat
A durva válasz
erősen exoterm. Itt −377 kJ mol -1 moláris reakcióhő valósul meg. A foszfor -pentoxid szintén elválasztja a vizet a vegyületektől. Például, salétromsavat termel a anhidridet dinitrogén-pentoxid , perklórsav termel dichloroheptaoxide , kénsavat termel kén-trioxid és a maionsav termel szén-szuboxid .
használat
A fentebb bemutatott egyensúly miatt a foszfor -pentoxid rendkívül hatékony szárítószer (lásd exszikkátor ): a környező levegőből származó, a foszfor -pentoxiddal érintkező vízmolekulák nagyon erősen kötődnek. A kereskedelmi célú szárítószerek 75% foszfor-pentoxidot és 25% inert szervetlen hordozóanyagot tartalmaznak, ami azt jelenti, hogy a szárítószer szabadon folyik. A szer kimerültségének mértéke vízjelzők hozzáadásával jelenik meg. Amikor a víz felszívódik, az eredetileg színtelen jelző színe zöldről, kékeszöldről kékre változik (víztartalom kb. 33%).
A gázokban, folyadékokban és szilárd anyagokban lévő víz magasabb vízgőznyomással rendelkezik, aminek következtében a vízmolekulák fokozatosan szinte teljesen a foszfor -pentoxidba vándorolnak. Ez kihat a kémiailag megkötött vízre (lásd kristályvíz ), sőt a szerves molekulákban vagy biológiai anyagokban külön megkötött hidrogén- és hidroxilcsoportokra is: ezeknek is van bizonyos vízgőznyomása, azaz egy OH csoport esetenként vízmolekulát képez egy szomszédos hidrogénatommal elpárolog, ha a levegő rendkívül száraz. Ez az egyensúly nem játszik szerepet a minket körülvevő és vízgőzt tartalmazó levegőben, de egy darab cukor az exszikkátorban elfeketedik, mint a sütőben felejtett torta (amely ugyanúgy elvesztette a vizet a hő hatására).
A műtrágyák foszfátokat tartalmaznak, mint pl B. KH 2 PO 4 kálium -dihidrogén -foszfát vagy diamónium -hidrogén -foszfát (NH 4 ) 2 HPO 4 , a foszfortartalmat gyakran foszfor -pentoxidban (P 2 O 5 ) adják meg .
Bár a foszfor-pentoxidot gyakorlatilag csak szárítószerként használják a szerves kémiában , kísérletileg kimutatták, hogy a foszfor-pentoxid kation annyira reakcióképes a gázfázisban, hogy még a legstabilabb is a szén-hidrogén kötések közül, nevezetesen a metán , hatékonyan képes aktiválni szobahőmérsékleten .
A vegyületet az iparban nagyon tiszta termikus foszforsav előállítására és szerves foszforsavészterek szintézisére használják . Az éterek megvalósítása a Trieszthez vezet.
Mono- és diésztereinek vannak kialakítva a alkoholokkal .
biztonsági utasítások
A foszfor -pentoxid súlyos égési sérüléseket okoz . Ezért a kezelés során kesztyűt, légzésvédőt és megfelelő laboratóriumi ruházatot kell viselni.
Egyéni bizonyíték
- ↑ a b c d e f g h i bevitel foszfor-pentoxid az GESTIS anyag adatbázisa az IFA , hozzáférhető a február 1, 2016. (JavaScript szükséges)
- ↑ a b c d e f g h i A. F. Holleman , N. Wiberg : Inorganische Chemie . 103. kiadás. 1. kötet: Alapok és főcsoport -elemek. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0 , 898–899 (kivonat: A. rész-A hidrogén kémiájának alapjai. Google könyvkeresés ).
- ↑ bevitel Foszfor-pentoxid az osztályozási és címkézési jegyzékbe az az Európai Vegyianyag-ügynökség (ECHA), elérhető február 1-jén, 2016. A gyártók és a forgalmazók is bővíteni a harmonizált osztályozás és címkézés .
- ↑ Svájci Balesetbiztosítási Alap (Suva): Határértékek-jelenlegi MAK és BAT értékek (keresés az 1314-56-3 vagy foszfor-pentoxidra ), hozzáférés 2015. november 2-án.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Szervetlen kémia tankönyve . 91. - 100., továbbfejlesztett és jelentősen kibővített kiadás. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3 , 644. o.
- ↑ Brauer G. (szerk.): A preparatív szervetlen kémia kézikönyve. 2. kiadás. kötet 1, Academic Press, 1963, 541-542.
- ↑ D. Stachel, I. Svoboda, H. Fuess: Phosphorus Pentoxide at 233 K. In: Acta Crystallographica , C51, 1995, 1049-1050, doi: 10.1107 / S0108270194012126 .
- ^ DWJ Cruickshank: Si, P, S vagy Cl és O vagy NV P 4 O 10 közötti kötéseket tartalmazó szerkezetek finomítása . In: Acta Crystallographica , 1964. 17., 677-679. O., Doi: 10.1107 / S0365110X64001670 .
- ↑ EH Arbib, B. Elouadi, JP Chaminade, J. Darriet: Az oP 2 O 5 kristályszerkezetének új finomítása . In: Journal of Solid State Chemistry , 127, 1996, 350-353. O., Doi: 10.1006 / jssc.1996.0393 .
- ↑ a b c d e f g Ralf Steudel : Chemistry of Non-Metals, Syntheses-Structures-Binding-Use , 4. kiadás, 2014 Walter de Gruyter GmbH & Co. KG, Berlin / Boston, ISBN 978-3-11-030439 - 8 , 408-409. O., (Elérhető a De Gruyter Online- on keresztül ).
- ↑ K. Schrödter, G. Bettermann, T. Staffel, F. Wahl, T. Klein, T. Hofmann: Foszforsav és foszfátok. In: Ullmann Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2008. doi : 10.1002 / 14356007.a19_465.pub3
- ↑ R. Crabtree: CH kötés aktiválása: radikális nemfém oldat. In: Természetkémia . 1, 2009, 348-349. (Eredeti munka: N. Dietl, M. Engeser. H. Schwarz: A metán C -H kötésének aktiválása melegen [P 4 O 10 ] + . In: Angewandte Chemie. 121, 2009, 4955 -4957 doi: 10.1002 / anie.200901596 )