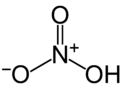
salétromsav
| Szerkezeti képlet | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Tábornok | ||||||||||||||||
| Vezetéknév | salétromsav | |||||||||||||||
| más nevek |
|
|||||||||||||||
| Molekuláris képlet | ENT 3 | |||||||||||||||
| Rövid leírás |
tiszta formájában színtelen folyadék, amely fény vagy meleg hatására részben bomlik sárga -vörös színű nitrogén -oxidokra |
|||||||||||||||
| Külső azonosítók / adatbázisok | ||||||||||||||||
| ||||||||||||||||
| tulajdonságait | ||||||||||||||||
| Moláris tömeg | 63,01 g mol -1 | |||||||||||||||
| Fizikai állapot |
folyadék |
|||||||||||||||
| sűrűség |
1,51 g cm -3 (20 ° C) |
|||||||||||||||
| Olvadáspont |
-42 ° C |
|||||||||||||||
| forráspont |
86 ° C |
|||||||||||||||
| Gőznyomás |
56 hPa (20 ° C) |
|||||||||||||||
| p K S érték |
-1,37 |
|||||||||||||||
| oldhatóság |
Vízzel minden arányban elegyedő, heves reakció etanollal |
|||||||||||||||
| biztonsági utasítások | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Toxikológiai adatok | ||||||||||||||||
| Amennyire lehetséges és szokásos, SI egységeket használnak. Eltérő rendelkezés hiányában a megadott adatok a szabványos feltételekre vonatkoznak . | ||||||||||||||||
A salétromsav (HNO 3 ), más néven elválasztó víz , a nitrogén legismertebb és legstabilabb oxigénsava . A savat 1908 óta ipari méretekben állítják elő Ostwald -eljárással ammónia katalitikus oxidációjával. Az ammóniát korábban légköri nitrogénből és hidrogénből állították elő Haber-Bosch eljárással .
A salétromsav sóit nitrátoknak nevezik . A név salétromsavat származik a közös neve néhány alkáli- és alkáliföldfémsók, a sav, amely végén a nevét salétromsavval , mint például a Pl .: nátrium -nitrát (Chile -nitrát), kálium -nitrát (kálium -nitrát), ammónium -nitrát ( ammónium -nitrát), kalcium -nitrát (mész -nitrát vagy kőműves -nitrát ), bárium -nitrát (baryta nitrát ). 1908 -ig a salétromsavat a különböző salétromsavakból erős, gyengén illékony sav (kénsav) hozzáadásával nyerik. A salétromsav -nitrát -sók nevét gyakran használják a salétromsav egyes szerves vegyületeinek - nevezetesen a salétromsav -észterek - megnevezésére. Tehát z. Például a salétromsav metil -észterét metil -nitrátnak nevezik (lásd még a nitrátokat ), bár az észterek kötési körülményei teljesen eltérnek a sókétól. A helyzet megnehezítése és a zavartság növelése érdekében az a tény, hogy a salétromsav egyes speciális észtereit nem helyesen nevezik észtereknek, és nem helytelenül nitrátoknak a mindennapi nyelvben, hanem inkább úgynevezett nitrovegyületeknek, mint pl. B. Nitroglicerin (helyes név: trisznitrinsav-glicerin-észter) vagy nitrocellulóz vagy cellulóz-nitrát .
Erős szervetlen savként a salétromsav vizes oldatban nagymértékben disszociál , és az ásványi savak egyike . A tiszta sav színtelen és éles, szúrós szagú. Többek között műtrágyák, festékek és robbanóanyagok gyártására használják.
sztori
A 12. századból származó De találmánye veritatis írásban megemlítik, hogy már a 9. században Geber arab alkimista nyers salétromsavat ("Aqua lahututiva ") használt salétrom ( lat. Sal petrae = kősó; KNO 3 ) száraz melegítésével . ), Cyprian Vitriol (CuSO 4 · 5 H 2 O) és a timsó (KAl (SO 4 ) 2 · 12 H 2 O) akkor mondjuk, hogy nyerték. A 13. században Albertus Magnus állítólag salétromsavat használt az arany és az ezüst elválasztására (víz, aqua fortis ). Sok írást azonban csak azért tulajdonítottak Albertus Magnusnak, hogy nagyobb súlyt kapjanak, valószínűleg a salétromsav használatával kapcsolatos írásokat is. Később, salétrom-ben melegítjük vas vitriol (FeSO 4 · 7 H 2 O), amely magasabb hozamot alacsonyabb hőmérsékleten.
A 17. század közepén JR Glauber tiszta spiritus nitri -t nyert, salétromsavat kénsavval átalakítva és desztillálva . Ezt a laboratóriumi eljárást ma is használják salétromsav előállítására, amelyet a középkorban aqua fortis -nak vagy ún. aqua valens, és az angol nyelvű világban erős víznek nevezték . A 18. század közepén AL Lavoisier felismerte a nitrogén és az oxigén kémiai elemeit a salétromsav összetevőjeként . A pontos összetételt Henry Cavendish határozta meg , akinek szintén sikerült a levegőben lévő nitrogénből elektromos kisüléssel szintetizálnia .
A hatékony termelés csak a 19. század elején kezdődött el, amikor elegendő mennyiségben olcsó kénsav és chilei nitrát állt rendelkezésre. Az elektromos ívben történő levegőégetést szintén nagyszabású folyamatgá fejlesztették ( Birkeland-Eyde folyamat , Kristian Birkeland és Sam Eyde után ), de ez csak az olcsó árammal rendelkező országokban volt versenyképes . Az ammónia platina feletti katalitikus oxidációját CF Kuhlmann (1838) fedezte fel . Amíg a találmány az ammónia szintézis által Haber és Bosch , azonban ammónia maradt túl drága, mint a Chile-nitrát. A 20. század elején Wilhelm Ostwald kifejlesztette a salétromsav előállítását ammóniából ipari érettségig. Az olcsó ammónia-oxidáció most felváltotta az összes többi nagyszabású eljárást.
Gyártás
A salétromsavat technikailag 1908 óta állítják elő Ostwald -eljárással . Ez a katalitikus oxidációja a ammónia . Az ammónia-levegő keveréket gyorsan eltelt (1/1000 s érintkezési idő) keresztül forró platina - ródium hálózatok ( katalizátor ). 800 ° C -on nitrogén -monoxid képződik , amely lehűlés után reagál a felesleges oxigénnel , és nitrogén -dioxidot képez , majd vízzel csorgó tornyokban körülbelül 60% -os salétromsavat képez. A 60% -os salétromsav desztillációval 68% -ig koncentrálható, ami megfelel az azeotropnak , amelynek forráspontja maximum (122 ° C). Magasabb koncentráció érhető el kénsavval (H 2 SO 4 ) vagy vizes magnézium -nitrát oldattal (Mg (NO 3 ) 2 ) végzett rektifikációval (dehidratálással), vagy nitrogén -tetroxid (N 2 O 4 ) sztöchiometriailag szükséges mennyiségével történő kezelésével. oxigén (vagy levegő) és víz.
Laboratóriumi méretekben salétromsavat állítanak elő tömény kénsav és nitrátok reagáltatásával . 1908 előtt salétromsavat nyertek ezzel a módszerrel nátrium -nitrát ( chilei nitrát ) alkalmazásával.
A sav halogénnel vagy hidrogén -halogeniddel gyakran előforduló szennyeződése ezüst -nitrát hozzáadásával és ezt követő desztillációval eltávolítható. A vízmentes salétromsavat desztillációval erősen koncentrált savból, közömbös gázon való áthaladással vagy foszfor -pentoxidon vagy oleumon végzett desztillációval nyerik .
tulajdonságait
A salétromsav tiszta állapotban színtelen. A tömény salétromsav azonban könnyen bomlik (különösen fény hatására), és gyakran sárgás vagy vöröses árnyalatú a benne oldott nitrogén -dioxid (NO 2 ) miatt .
A tiszta salétromsavat, amely szabad nitrogén -dioxidot tartalmaz, füstölgő salétromsavnak nevezzük. Több mint 90% HNO 3 -at tartalmaz , erős oxidáló hatása van, és meggyújthat néhány nagyon gyúlékony anyagot; ezért a 70% -os salétromsavat oxidálónak tekintik . A salétromsavat, amelyet az oldott nitrogén -dioxid sárgára színez , kis mennyiségű karbamid vagy jobb esetben karbamid -nitrát elszínezheti.
A salétromsav erős oxidálószer és erős sav is . A nemfémes elemek , például a szén , a jód , a foszfor és a kén vannak oxidáljuk által tömény salétromsavval való oxidok vagy oxo savak képződése nitrogén -dioxid , például a
Ezenkívül sok vegyületet salétromsav oxidál. Sósav van oxidálva , hogy a klór és a klór -dioxid.
A nitrátok , a salétromsav sói képződnek, amikor fémek vagy oxidjaik , hidroxidjaik vagy karbonátaik reagálnak salétromsavval. A legtöbb nitrátok vízben oldódnak, és a salétromsav főleg, hogy hogy az oldható fém-nitrátok.
A salétromsav a legtöbb fémmel reagálva vízoldható nitrátokat képez. Kivételt képeznek az arany , a platina és az irídium nemesfémek . Ezenkívül az alumínium , titán , cirkónium , hafnium , niobium , tantál és volfrám ellenáll a salétromsav passzivációnak . Továbbá a passziválás következtében a vas ellenáll a hideg salétromsavnak , és a króm a forró salétromsavnak is. Szorosan tapadó, nem áteresztő oxidréteg képződik a fémen. Mivel az aranyat és az ezüstöt ilyen módon el lehetett különíteni, korábban elválasztó víznek nevezték . A salétromsav sósavval ( aqua regia ) vagy szelénsavval alkotott keverékei szintén reagálnak az arannyal és a platinával.
Salétromsav színek fehérjék , amelyek tartalmaznak az aromás aminosavakat , például L- fenil-alanin vagy L- tirozin sárga által nitrálásával a benzolgyűrű . Ez a xantoprotein reakció aromás aminosavak és fehérjék kimutatására használható.
| Tömeg% HNO 3 | 0 | 10 | 20 | 30 -án | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Sűrűség (g / cm 3 ) |
1.00 | 1.05 | 1.12 | 1.18 | 1.25 | 1.31 | 1.37 | 1.42 | 1.46 | 1.48 | 1.513 |
|
Viszkozitás (mPas) |
1.00 | 1.04 | 1.14 | 1.32 | 1.55 | 1.82 | 2.02 | 2.02 | 1.84 | 1.47 | 0,88 |
| Olvadáspont (° C) | 0 | −7 | −17 | −36 | −30 | −20 | −22 | −41 | −39 | −60 | −42 |
| Bp (° C) | 100,0 | 101.2 | 103.4 | 107,0 | 112,0 | 116.4 | 120,4 | 121.6 | 116.6 | 102,0 | 86,0 |
| p (HNO 3 ) (mbar) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.3 | 1.2 | 3.9 | 14,0 | 36,0 | 60,0 |
| p (H 2 O) (mbar) | 23.3 | 22.6 | 20.2 | 17.6 | 14.4 | 10.5 | 6.5 | 3.5 | 1.2 | 0.3 | 0.0 |
| HNO 3 (mol / l) | 1.7 | 3.6 | 5.6 | 7.9 | 10.4 | 13,0 | 15.8 | 18.5 | 21. | 24.01 |
használat
A salétromsav a vegyipar egyik legfontosabb nyersanyaga. Ő szolgál:
- a termelés nitrátok és műtrágyák ,
- mint elválasztó víz elválasztására ( quartation ) arany és ezüst (ezüst reakcióba lép, oldható ezüst-nitrát ),
- sósavval, mint aqua regia keverékben az arany feloldására, valamint az aranyozásra és az arany kimutatására,
- A pácolás és égő fémek (grafika és galván technológiával),
- fémek polírozására,
- zsírok (vízben való oldhatóság) cseréje tisztítás céljából,
- előállítására celluloid , nitro- lakkok és zapon lakkok ,
- A rakéta üzemanyagok , mint oxidáló szerek ( WFNA és RFNA ).
- a nitrálási szerves anyagok a termelés színezékek , gyógyszerek , fertőtlenítőszerek és robbanóanyagok , mint a nitroglicerin vagy lőgyapot ,
Utóbbi használhatóság miatt az EU 2021. február 1 -je óta a salétromsavat a 3% -ot meghaladó tartalmú keverékek közé sorolta a robbanóanyagok korlátozott kiindulási anyagainak egyikeként, aminek következtében felhasználása, birtoklása, átadása és forgalmazása és tilos olyan személyek számára, akik nem szakmai vagy kereskedelmi célokból járnak el; Eladáskor ellenőrizni kell a szakmai vagy kereskedelmi célt, és jelenteni kell a gyanús ügyleteket .
bizonyíték
Mint nitrátok, salétromsav lehet kimutatni a laboratóriumban segítségével a gyűrűs teszt és Lunge-reagens .
biztonsági utasítások
A salétromsav maró hatású a bőrre, a légutakra és a nyálkahártyákra. A gőzök belégzése mérgező tüdőödémához vezethet . Ez a veszély különösen melegítéskor vagy a tömény sav használatakor áll fenn. Nagy koncentrációban erős oxidálószer és tűzgyorsító hatású. A salétromsav a legtöbb fémmel reagálva mérgező nitrogén -dioxidot képez . Ha salétromsavval, védőszemüveggel vagy arcvédővel dolgozik, megfelelő védőkesztyűt és zárt munkaruhát kell viselni. Ha fennáll annak a veszélye, hogy salétromsav -gőzök vagy nitrogén -oxidok szabadulnak fel a helyiségben, légzőkészüléket kell viselni. Emiatt a salétromsav nem alkalmas háztartási tisztításra. A laboratóriumban végzett munka mindig füstszekrényben történik. Teflon kupak ajánlott koncentrált salétromsavat tartalmazó palackokhoz.
Lásd még
- Salétromsav (HNO 2 )
web Linkek
- Iskola szempontjából releváns információk a salétromsavról a www.seilnacht.com oldalon, természettudományok oktatása .
Egyéni bizonyíték
- ↑ Bejegyzés a salétromsavra. In: Römpp Online . Georg Thieme Verlag, hozzáférés: 2014. november 12.
- ↑ a b c d e f g h bevitel salétromsavval a GESTIS anyag adatbázisa az IFA , hozzáférhető a január 8, 2021. (JavaScript szükséges)
- ↑ CCI ETH: pK s táblázat
- ↑ Adatlap 100% salétromsav (PDF) a Merck cégtől , hozzáférés 2018. január 23 -án.
- ↑ bevitel salétromsav ...% az osztályozási és címkézési jegyzékbe az az Európai Vegyianyag-ügynökség (ECHA), elérhető január 24-én, 2017. A gyártók és a forgalmazók is bővíteni a harmonizált osztályozás és címkézés .
- ↑ A Szövetségi Munkavédelmi és Egészségügyi Intézet (BAuA) Veszélyes Anyagok Bizottsága (AGS) : Technical Rules for Hazardous Substances (TRGS) 900 ( PDF ), hozzáférhető 2014. június 10 -én.
- ↑ Svájci Balesetbiztosítási Alap (Suva): Határértékek-jelenlegi MAK és BAT értékek ( 7697-37-2 vagy salétromsav keresése ), hozzáférés 2015. november 2-án.
- ↑ Biztonsági adatlap Bernd Kraft, 2019. május 29. PDF , hozzáférés: 2020. január 20.
- ↑ Thomas Gleinser: Anna von Diesbach berni „Gyógyszerkönyve” Daniel von Werdts (1658) Erlacher -változatában, II. Rész: Szószedet. (Orvosi értekezés Würzburg), most Königshausen & Neumann, Würzburg 1989 (= Würzburgi orvostörténeti kutatás. 46. kötet), 38. o.
- ↑ G. Brauer (szerk.), Handbook of Preparative Inorganic Chemistry , 2. kiadás, Vol. 1, Academic Press 1963, 491-492.
- ↑ Erwin Riedel , Christoph Janiak : Szervetlen kémia. 8. kiadás. de Gruyter, 2011, ISBN 3-11-022566-2 , 458. o.
- ↑ M. Thiemann, E. Scheibler, KW Wiegand: salétromsav, salétromsav és nitrogén-oxidok az Ullmanns Enzyklopädie der Technischen Chemie , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, doi : 10.1002 / 14356007.a17_293 .
- ↑ A robbanóanyagok prekurzorainak forgalmazásáról és használatáról szóló, 2019. június 20 -i (EU) 2019/1148 európai parlamenti és tanácsi rendelet 5. cikke , az I. melléklet hatálybalépése, 23. cikk, vizsgálati és jelentési kötelezettségek gazdasági szereplők és online piacterek 8. és 9. cikk. Németországban büntetendő a birtoklás, a használat és az alkalmazási tilalom megsértése az alapanyag -törvény 13. szakasza szerint .
- ↑ Thomas Seilnacht: természettudományok oktatása , salétromsav és Thomas Seilnacht: DVD-ROM kémia , Seilnacht Verlag & Atelier, Bern 2017.









