UV / VIS spektroszkópia
Az UV / VIS spektroszkópia egy optikai molekuláris spektroszkópia, amely spektroszkópiai módszer , az ultraibolya (UV) és a látható ( angolul látható , VIS) fény elektromágneses hullámait használják fel. A módszert UV / VIS spektrofotometriának vagy elektronabszorpciós spektroszkópiának is nevezik . A mindennapi életben a használt eszközöket gyakran pontatlanul nevezik fotométereknek .

elv
A látható és az ultraibolya sugárzás tartományának fényelnyelését a molekula különböző állapotai közötti elektronátmenet okozza . Ezen átmenetek során a vegyérték elektronok (például a külső héjak p és d pályájának elektronjai ) gerjesztődnek, vagyis magasabb energiaszintre emelkednek.
Például ahhoz, hogy egy elektron elfoglaltról ( HOMO ) egy szabad, magasabb pályára ( LUMO ) emelkedjen , az elnyelt foton energiájának pontosan meg kell felelnie a két energiaszint közötti energiakülönbségnek. A kontextusról
- Δ
, A hullámhossz az abszorbeált fény számítjuk a ráfordított energia, az energia , a Planck-állandó , a fény sebessége , a frekvencia és a hullámhossz az elektromágneses hullám. Ezt a kapcsolatot néha Einstein-Bohr-egyenletnek nevezik. Ez a kapcsolat nagyjából egyszerűsített formában ábrázolható személyre szabott méretegyenlet formájában :
Azok az anyagok, amelyek csak az UV-tartományban ( <400 nm) abszorbeálódnak, színtelennek tűnnek az emberi szem számára. Az anyagot akkor nevezzük színesnek, ha a látható spektrum tartományában elnyeli a sugárzást . Erre számítani kell mind alacsony gerjesztési energiájú vegyületekkel (π-to-π * átmenetek, konjugált π-elektron rendszerek, például a poliének esetében ), mind a nem teljesen kitöltött elektronszinttel rendelkező szervetlen ion komplexekkel (példa: Cu 2 + - Kapcsolatok (többnyire kékes - zöldes), szemben a színtelen Cu + vegyületekkel). A kapcsolatok akkor is színesnek tűnnek, amikor erősen polarizáló kölcsönhatások vannak a szomszédos részecskék között, mint például B. a sárga AgI . Ha csak egy abszorpciós terület van, a szem érzékeli azt a színt, amely kiegészíti az elnyelt sugárzást .
Alapvetően a sugárzás abszorpciójának jelenségeit elsősorban az UV / VIS spektroszkópia keretében értékelik . Alapvető felépítésében a fényforrás elektromágneses sugárzást bocsát ki, amelyet a mintán / elemzőn keresztül tükrökkel és egyéb alkatrészekkel ellátott sugárútvonalon keresztül vezetnek (az alábbiakban részletezzük), majd elüt egy detektor. A mintában izgalmas elektronok által a sugárzás intenzitása gyengül a megfelelő területeken az eredeti primer nyalábhoz képest. A sugárzás intenzitásának ezt a különbségét ábrázoljuk annak a hullámhossznak a függvényében, amelyen a mérést végeztük, és kimenő spektrumként adtuk meg .
Kétsugaras UV / Vis spektrométer felépítése
A fényforrás ultraibolya, látható és infravörös fényt bocsát ki, a hullámhossz-tartományban körülbelül 200 nm és 1100 nm között. A mérésre kiválasztott hullámhosszat először a monokrómban választják ki, ekkor a fénysugár a szektortükörre esik. A szektortükör felváltva engedi a fényt a mérési megoldáson és az összehasonlító megoldáson keresztül. Mindkét megoldás úgynevezett küvettában található . A két fénysugarat az érzékelő fogadja, és az erősítőt összehasonlítja az erősítővel. Ezután az erősítő a fésű membránjának visszahúzásával beállítja az összehasonlító oldat fénysugarának intenzitását a mérési megoldás fénysugarának intenzitásához. Ez a mozgás átkerül egy rögzítőbe, vagy a mért értékeket továbbítja egy adatfeldolgozónak.
Sejtmentes UV / VIS spektrométereket egyre inkább alkalmaznak a kisebb koncentrációjú minták (kevesebb, mint 2 mikroliter) koncentrációjának meghatározására. Az úgynevezett nanofotométerek 0,04 mm és 2 mm közötti rétegvastagsággal működnek. Nincs szüksége küvettára, hígításra, és csak 0,3 µl térfogatú mintákat lehet elemezni (a legkisebb rétegvastagsággal), de a kis rétegvastagság miatt magasabb a kimutatási határ . A bevált technika a minta összenyomásán alapul, amely ezért független a minta felületi feszültségétől és párolgásától. Ezt a módszert nukleinsavak (DNS, RNS, oligonukleotidok) és fehérjék (UV abszorpció 280 nm-en) elemzésére használják . A Lambert-Beer törvény szerint összefüggés van az abszorpció és a rétegvastagság között. Így kiszámolhatók a különböző rétegvastagságok (0,04 mm - 2 mm) abszorpciós értékei. A kis rétegvastagságok úgy viselkednek, mint a minta virtuális hígítása, de csak ennek megfelelő nagyobb koncentrációknál alkalmazhatók. A minta kézi hígítása ezért gyakran teljes mértékben mellőzhető.
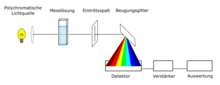
Diódasoros UV / VIS spektrométer felépítése
Egy másik technológia a diódasoros technológia. A küvettában lévő mintát egy fénysugárral besugározzuk, amely a fényforrás folyamatos hullámhossztartományából áll (például xenon-villanólámpa , 190–1100 nm). A mérés során a minta különböző hullámhosszakat nyel el a fényforrástól. A fel nem szívódott fény áthalad a bejárati résen, és diffrakciós rácson oszlik fel hullámhosszának megfelelően. A spektrumot CCD érzékelő segítségével detektálják, majd kiértékelik. Nem automatizált eszközök esetében a referencia mintát is meg kell mérni. A technológia előnyei a rövid mérési idők, mivel a teljes UV / VIS spektrum egy méréssel rögzíthető, alacsony karbantartási költségek, mivel a spektrométerben nincsenek mozgó alkatrészek, és hogy az eszközök kompakt módon építhetők fel.
Kémiai példák
A π-π * átmenetek a telítetlen szénhidrogének ( például alkének ) esetében hasznosak . Hosszabb hullámú UV-fény felhasználásával készülnek, és könnyen mérhetők. Információt kapunk a molekula abszorpciós hullámhosszáról, szerkezetéről és színéről . A fényelnyelés a hosszabb hullámtartományban zajlik, annál nagyobb a konjugált kettős kötések száma . Ha a π-π * átmenetek energiája a látható fény tartományában van, akkor a molekula színesnek tűnik. Mindig felveszi az elnyelt fény kiegészítő színét.
A vizsgált elektronátmeneteknél (ideértve Laporte szabályát is ) mindig be kell tartani a következő kiválasztási szabályokat :
- Forgási szabály: A teljes centrifugálást meg kell tartani
- Tilos a különböző pörgetési szorzók közötti átmenet . A gerjesztés csak akkor megengedett, ha a molekula teljes spinje nem változik, vagyis ha ugyanannyi párosított és párosítatlan elektron (spin) van jelen a gerjesztés előtt és után.
- Az átmenet tilalma egyenlő paritással (Laporte-tilalom)
A Laporte-tilalom esetében két kérdést kell megtenni a ligandumtér-elmélet szerint.
- Van-e a molekulának inverziós központja? Ha igen (pl. Oktaéder), akkor gerjesztés egyelőre nem megengedett. Ha nem (pl. Tetraéder), akkor gerjesztés megengedett.
- Változik-e a pályák paritása (előjele)? Ha igen, akkor gerjesztés megengedett (pl. Átmenet az s → p pályáról). Ha nem, akkor a gerjesztés nem megengedett (pl. Átmenet a p → f pályáról). Az átmenet csak a párosról a páratlanra, vagy a páratlanról a párosra történhet (az s és d pályák párosak, a p és f pályák páratlanok).
Például.:
- A 3s → 4s átmenet tilos
- a 3s → 4p átmenet megengedett
Figyelem: A tiltott nem azt jelenti, hogy ezek az átmenetek nem történnek meg! A komplexek gyenge színét a ligandumok fémközéphez viszonyított rezgései okozzák. Ennek eredményeként az inverziós szimmetria, amely fontos volt a Laporte-ban, ideiglenesen törlődik, és átmenet történhet.
Lásd még
web Linkek
- ETH zürichi adatbázis és referenciamunkák könyvtár UV / VIS spektrumokkal
- Mettler-Toledo fehér könyve: UV / VIS spektrométerek összehasonlításban: diódarendszer és szkennelési technológia
Egyéni bizonyíték
- ↑ Manfred Reichenbächer, Jürgen Popp: [ korlátozott előnézet a szerves és szervetlen vegyületek Google könyvkeresési struktúrájának elemzésében: füzet] . Springer Science & Business Media, 2007. szeptember 25, ISBN 978-3-8351-0190-6 , 119. o.
- ^ Christopher G. Morris, Academic Press: Tudományos és technológiai tudományos szótár . Gulf Professional Publishing, 1992, ISBN 0-12-200400-0 , pp. 716 ( korlátozott előnézet a Google Könyvkeresőben).
- ↑ Szerzők kollektívája, vezető szerzők: K. Doernel, R. Geyer: Analytikum - Az analitikai kémia módszerei és elméleti alapjaik . 8. kiadás. VEB német kiadó az alapipar számára, Leipzig 1990, ISBN 3-342-00191-7 , p. 259 ff .
- ↑ H. Stranneheim, J. Lundeberg: ugródeszkaként DNS-szekvenálás. In: Biotechnológiai folyóirat. 7. évfolyam , 9. szám, 2012. szeptember, ISSN 1860-7314 , 1063-1073 . O. , Doi: 10.1002 / biot.201200153 , PMID 22887891 . PMC 3472021 (ingyenes teljes szöveg).
- ^ PO Michel, C. Degen, M. Hubert, L. Baldi, DL Hacker, FM Wurm: NanoDrop alapú módszer az életképesség csökkenésének gyors meghatározására állati sejtek szuszpenziós tenyészeteiben. In: Analitikai biokémia. 430. évfolyam , 2. szám, 2012. november, ISSN 1096-0309 , 138-140. Oldal, doi: 10.1016 / 2012.08.028 . J.ab. , PMID 22960013 .
- ↑ MT Kelliher, MS Piraino, ME Gemoules, CA Southern: A Förster-rezonancia-energiaátadási elemzés megközelítésének összehasonlítása a nanodrop fluorometriához. In: Analitikai biokémia. 441. évfolyam , 1. szám, 2013. október, ISSN 1096-0309 , 44-50. O. , Doi: 10.1016 / j.ab.2013.06.009 , PMID 23811157 .
- ^ Owen T.: A modern UV-látható spektroszkópia alapjai: alapozás . 1996.
- ↑ Joseph B. Lambert, Scott Gronert, Herbert F. Shurvell, David A. Lightner: Spektroszkópia - struktúra tisztázása a szerves kémia 2. kiadásában, Pearson Németország, München 2012, ISBN 978-3-86894-146-3 , 591. o. - 653.