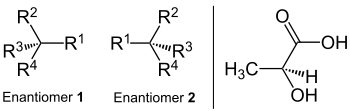
Enantiomer
Az enantiomerek olyan kémiai vegyületek sztereoizomerjei, amelyek összetétele megegyezik, és amelyek térbeli szerkezete olyan párhoz kapcsolódik, mint annak (nem egyező) tükörképe. Emiatt tükörkép izomereknek is nevezik őket . A görög elnevezés ezt a jelentést mutatja: ἐνάντιος, megfelelője és μέρος, része vagy területe. A molekuláris képlet és a megfelelő atomképződések kapcsolata megegyezik. Ez a konfigurációs izoméria egy formája ; A konformációs izomerekkel ellentétben az enantiomereket nem lehet egybeesni forgó atomkötésekkel. Mivel az összes sztereocentrum enantiomerjei ellentétes konfigurációjúak, elméletileg mindig van egy ( -) - és egy (+) - enantiomer, amelyek közül azonban gyakran csak egy van jelen a természetben.
fizikai és kémiai tulajdonságok
Ezt a fajta izomerizmust kirilitásnak (kézfogásnak) nevezik . Az enantiomerek tükörképének illusztrálásához testrészek, például bal és jobb kéz vagy mindennapi tárgyak, például bal és jobb cipő, valamint bal és jobb oldali csavarok vagy anyák használhatók. A két térbeli változatban előforduló molekula példája a joghurtban lévő tejsav . Az enantiomerek mindig ellentétes konfigurációjúak minden sztereocentrumban. Másrészt ott vannak a diasztereomerek , amelyekben legalább egy sztereocentrum több azonos és legalább egy másképpen van konfigurálva (lásd ott).
Az enantiomerek rendelkeznek, kivéve a optikai aktivitása azonos fizikai tulajdonságokkal rendelkezik, mint olvadás- és forráspontja, sűrűség, oldhatóság, az infravörös spektrumokat, röntgendiffrakciós spektrumok, stb Ezek optikailag aktív, így forgó polarizációs síkját a lineárisan polarizált fényt az óra járásával megegyező irányba ( dextrorotatory forma, beleértve a (+) -Form vagy korábban d -formát) vagy az óramutató járásával ellentétes irányba ( balra forgó forma, ( -) -forma vagy korábban l -forma). A forgás érzését a megfigyelő látási irányához, nem pedig a sugár irányához kell érteni. Az enantiomerek a lineárisan polarizált fény polarizációs síkját ugyanolyan mértékben forgatják az ellenkező irányba.
A kiindulási anyag két enantiomerje másképp reagál azokban a kémiai reakciókban, amelyekben egy másik enantiomerileg tiszta reakciópartner vesz részt. A reakcióátmeneti állapotok ekkor diasztereomerek egymással. Még akkor is, ha gyógyászati anyagként használják az élőlényekben, az egymáshoz enantiomer anyagok eltérő hatást fejtenek ki. Ezt szemléltethetjük egy példával a mindennapi életből, kesztyű felvétele: Világos, hogy csak a megfelelő kesztyű illik a jobb kézhez. Ha megpróbálja a jobb kesztyűt a bal kezére húzni, akkor kudarcot vall, vagy csak nagyon rossz eredményt ér el. A kívánt hatás helyett az ember haszontalan vagy káros és így nemkívánatos eredményt ér el.
Jelentőség a biológiai hatás szempontjából
Sok biológiailag fontos anyag királis, nemcsak az aminosavak és cukrok kisebb molekulái , hanem biológiai makromolekulák is, például enzimek vagy receptorok. Egyes anyagosztályokban gyakran egy enantiomer van túlsúlyban, például szinte minden természetes aminosav L -alakú. A D -forma van a természetes cukrok (például, D - glükóz ) nagyon domináns, L cukrok ritkák exotikus. A kiralitás, mint a molekulák térbeli szerkezetének következménye, döntő fontosságú a biológiai rendszerek működése szempontjából, amelyek maguk is királisak. Sok enzim reakciókat ezért szakosodott egyik enantiomer, akár a balra forgató , illetve a jobbra forgató : A reakció sebességét a tükörkép enantiomer, szubsztrát jelentősen lassabb, vagy akkor nem alakul egyáltalán, mivel az aktív centrum Egy enzim gyakran akár egy enantiomer könnyebben, mint a többi ( zár és kulcs elv , szubsztrát specifitás ).
A szubsztrát specificitását az enantiomerekre vonatkozó hárompontos interakciós koncepcióval lehet szemléltetni, amint azt a képi séma mutatja: az A királis enantiomer egybevág a receptorral. Az A enantiomer, a B enantiomer tükörképe azonban nem megfelelő, ami kötési problémákhoz vezethet, és így befolyásolhatja egy anyag (például egy gyógyszer ) hatását . Különbségek lehetnek a farmakodinamikában vagy a farmakokinetikában. A nagyobb aktivitású vagy affinitású enantiomert eutomernek , az alacsonyabb aktivitást vagy affinitást pedig distomernek nevezzük.
Nem ritka, hogy a „rossz” enantiomer teljesen más biológiai hatást fejt ki. Példák:
- Íz: Az aminosav ( S ) - a valin keserű, ( R ) a valin édes,
- Szag: A terpén ( S ) - (+) - carvone köményszagú, enantiomerje ( R ) - ( -) - carvone menta illatú.
- A béta -blokkolók farmakológiai hatásai : A béta -blokkolókban az ( S ) -enantiomer szelektíven hat a szívre, míg az ( R ) -enantiomer a szem sejtmembránjára. A nagy enantiomer tisztaság ezért nagy jelentőségű számos gyógyszer esetében.
- A talidomid farmakológiai hatásai : A talidomid -botrány tudatában volt a nyilvánosságnak a talidomid teratogén hatásaival. Ezt korán összefüggésbe hozták egy és ugyanazon anyag két enantiomerjének különböző hatásaival, mivel a talidomid ( S ) -enantiomerjének önmagában teratogén ( teratogén ) hatása van, de az ( R ) -enantiomernek nincs.
A talidomid -enantiomerek azonban rendelkeznek azzal a tulajdonsággal, hogy körülbelül nyolc órán belül egymással átalakulnak (racemizálódnak). Az ( R ) -konfigurált talidomid használata csak a gyakorlatban marad értelmetlen.
A különböző hatású enantiomer hatóanyagok szintetikus előállítása során, például a farmakológiában, most csak a kívánt hatású enantiomert állítják elő, és gyógyszerészeti hatóanyagként használják fel, míg a másik enantiomert a nemkívánatos - akár toxikus - hatás, amelyet ki kell zárni a kezdetektől ( enantioszelektív szintézis ). Alternatív megoldásként a racemátot (két enantiomer 1: 1 arányú keverékét) racemát felbontásnak vethetjük alá, hogy egységes (= enantiomerileg tiszta) hatóanyagot kapjunk, amely ezután farmakológiailag aktív lehet, és sokkal nagyobb szelektivitással rendelkezik, mint a racemát.
Az anyagok illata vagy íze az enantiomertől függően is eltérő lehet, mivel a szervezetben lévő megfelelő receptorok mindig maguk is királisak (pontosabban: enantiomerileg tiszták).
Az enantiomerek általában másképp metabolizálódnak a biológiai rendszerekben.
Racemát
A (+) - és ( -) - formájának 1: 1 arányú keverékét, amelyben az egyes anyagok optikai aktivitása kiegyensúlyozott, racemátnak , pl. B. (±) -metionin [szinonimák: DL -metionin és ( RS ) -metionin]. Nem optikailag aktív, és α elforgatási szöge 0 °, mivel a jobbra és balra kanyarodó alkatrészek kiiktatják egymást. A mért forgásszög és a tiszta enantiomer maximális forgási szögének hányadosa 100 -szor szorozva adja meg az enantiomer keverék optikai tisztaságát (%). Ideális viselkedést feltételezve (nincs kölcsönhatás a két enantiomer között és érvényes a Lambert-Beer törvény ), az optikai tisztaság megegyezik az ee enantiomer feleslegével .
A racemát olvadáspontja általában eltér a tiszta enantiomerek olvadáspontjától. A racemát olvadáspontja alacsonyabb vagy magasabb lehet, mint a tiszta enantiomereké. Ez az első pillantásra váratlan jelenség megmagyarázható: Ha a racemát racém keverékként (konglomerátumként) kristályosodik ki, akkor a (+) - és ( -) - alakú kristályok külön vannak jelen egymás mellett, azaz vagyis a (+) - enantiomer nagyobb affinitással rendelkezik a (+) - molekulák iránt, a ( -) - enantiomer pedig nagyobb affinitással ( -) - molekulák iránt. Kristályosodáskor tiszta (+) és (-) kristályok jönnek létre „egymás mellett”. A „racém keverék” olvadáspontja jóval a tiszta enantiomerek olvadáspontja alatt van. Példa: A glutetimid hatóanyag tiszta (+) - és ( -) - enantiomerje 102-103 ° C -on olvad. Ezzel szemben a (±) -glutetimid, azaz a racém keverék olvadáspontja 84 ° C.
Más a helyzet, ha a kristályosítás során a (+) - enantiomerek előnyösen egyesülnek a ( -) - enantiomerekkel. Ekkor "minden" kristály azonos számú "mindkét" enantiomer molekulát tartalmaz. Ezt az esetet racém vegyületnek nevezik . A racém vegyület fizikai tulajdonságaiban különbözik a tiszta enantiomerektől. Az olvadáspont lehet magasabb, egyenlő vagy alacsonyabb, mint a tiszta enantiomereké. Példa: Az ibuprofen hatóanyag tiszta enantiomerjeinek olvadáspontja 50-52 ° C, a racém ibuprofen olvadáspontja 75-77,5 ° C. A racém ibuprofen így racém vegyületként kristályosodik.

R és S szekvencia szabály (CIP szabály)
- Az enantiomereket az R és S szekvencia szabály szerint osztályozzák.
- Annak megállapításához, hogy egy enantiomer rendelkezik -e ( R ) - vagy ( S ) -konfigurációval, az összes szubsztituenst a prioritásuk szerint kell rendezni: 1> 2> 3> 4. A legalacsonyabb prioritású szubsztituenst (4) a papír szintje alá forgatjuk. Most lépj 1 -ről 2 -re 3 -ra.
- Ha az irányt, amelyben mozogni, a fut óramutató járásával megegyező irányban, a enantiomer ( R ) konfigurációjú (a lat. Rectus , jogilag, jobb, jobb „)
- Ha az irányt, amelyben mozgatni, ellen az óramutató járásával megegyezően, a enantiomer ( S ) konfigurációjú (a Lat. Sinister , balra „)
- Lásd még: A Cahn-Ingold-Prelog egyezmény a szubsztituensek rangsorolásának magyarázatához.
Az óramutató járásával megegyező irány, amely a helyettesítők prioritásainak számításából adódik a konfiguráció meghatározásához [( R ) vagy ( S )], nem tudja automatikusan meghatározni az α forgásszöget vagy a forgásirányt [(+) vagy (-)] a lineárisan polarizált fény lezárásának polarizációs síkjától. Példák:
- ( S ) - Az alanin α elfordulási szöge + 13,0 ° (c = 2 5 N sósavban)
- ( R ) - A cisztein α elfordulási szöge + 7,9 ° (c = 2 5 N sósavban)
elnevezéstan
Az enantiomerek megkülönböztetésére a CIP konvenciót (Cahn-Ingold-Prelog konvenció, szintén RS nómenklatúra) használják, amellyel a szubsztituensek térbeli elrendezését írják le. Bizonyos anyagosztályoknál (cukor, a biokémiára korlátozva az aminosavak esetében is) továbbra is a régebbi Fischer -vetületet ( D , L -nómenklatúra) használják, amelynek előnye, hogy a rokon vegyületek neve megegyezik. Egy kapcsolat nevében a fény forgásiránya egyértelművé tehető a "(+) -" hozzáadásával az óramutató járásával megegyező irányban vagy a "( -) -" jelzéssel az óramutató járásával ellentétes irányban; z. B. ( -) - borkősav vagy (+) - tejsav , de ez a leírás nem mindig egyértelmű, mert az alkalmazott oldószer bizonyos esetekben befolyásolhatja a forgás irányát, és így megváltoztathatja azt.
Gyakran a Levo- vagy Lev- (bal) előtagot használják balra forgó anyagokhoz, és Dex- vagy Dextro- (jobbra) jobbra forgó anyagokhoz.
Példák:
- Levodopa , levotiroxin , levonorgesztrel , levofloxacin , levobupivakain , levetiracetám , levocetirizin
- Dextróz , dexamfetamin , dexibuprofen , dexketoprofen , dextrometorfán , dexrazoxán , dexklórfeniramin
A CIP nómenklatúrából származtatott gyógyászati anyagok ( S ) -enantiomerjeinek Es- és ( R ) -enantiomerei előtagja lehet az Ar- előtag, ha a racém anyagnak már nincs szabadalmaztatott neve. Ezzel szemben a Rac- előtag időnként a racemátok megjelölésének triviális vagy enantiomer neve elé kerül .
Példák:
- Armodafinil , arhalofenát
- Eszopiclone , ezomeprazol , escitalopram , esketamine
- Racecadotril , Racepinephrine
sztori
1848-ban Louis Pasteur sikerült megoldani a racemát az enantiomerek egy sóját D - és L - borkősav . Számára csak annyiban különböztek egymástól, hogy kristályaik tükörképben épültek fel. Gondos kristályosítás után képes volt kézzel fáradságosan szétválasztani a különböző kristályokat, és így megkezdte az enantiomerizmus tanulmányozását. Borkősav is fontos szerepet játszott a egyesülő a optikai aktivitása egy anyag és az abszolút konfiguráció a molekulák által Johannes Martin Bijvoet . A nátrium -rubídium -tartarát (borkősav) központi szerepet játszott az enantiomer tiszta molekulák abszolút konfigurációjának megbízható megvilágításában. A felfedezőket ezért kémiai Nobel -díjjal tüntették ki.
kémia
A szintetikus kémiának ma már módszerei vannak a tiszta hatóanyag -izomer közvetlen, célzott előállítására a természet modelljén alapuló enantioszelektív vagy akár enantioszpecifikus szintézisek révén.
Aszimmetrikus szintézis
A királis anyagok kémiai szintézisei általában mindkét enantiomert azonos arányban állítják elő. Fáradságosan szét kell választani őket, hogy tiszta anyagként megkapják az enantiomereket . Az enantiomer tiszta molekulák szintézise az egyik legnehezebb terület a preparatív szerves kémiában. Számos újabb szintetikus módszer, amelyek közül néhány nagyon magas enantioszelektivitással rendelkezik , kiutat kínál . Különféle módszereket fejlesztettek ki annak érdekében, hogy a királis molekula hozzáférhető legyen a nem királis kiindulási anyagokból:
- Királis segédreagensek és katalizátorok (pl. Királis foszfinok) használata
- Végrehajtás enzimekkel
- Melléklet egy kiegészítő , amely lehet után ismét eltávolítjuk a reakció
- Átalakítás diasztereomerekké [enantiomer tiszta szubsztituens, például ( -) - sztrichnin hozzáadásával ] és ezek szétválasztása (pl. Kristályosítás, oszlopkromatográfia stb.)
Az így elért enantiomer tisztaság gyakran eltérő. Az enantiomer felesleget az aszimmetrikus szintézis / kristályosodás sikerének mércéjeként adjuk meg:
Ezenkívül az enantiomer tiszta hatóanyagok szintézise királis természetes termékekből (példák: aminosavak , szénhidrátok , terpének , alkaloidok , szteroidok ) továbbra is fontos és hatékony módszer.
Gyógyszer szintézis
Everhardus Ariëns farmakológust fontos úttörőnek tekintik a célzott enantiomer tiszta gyógyszer -szintézisben. A szintetikus kémia továbbfejlesztésével a tiszta enantiomerek sztereoszelektív, teljesen szintetikus előállítása egy -néhány királis centrummal manapság gyakran nagy erőfeszítés nélkül lehetséges. A sok aszimmetriaközponttal rendelkező gyógyszereket ezzel szemben természetes anyagok felhasználásával állítják elő, néhány kivételtől eltekintve, félszintetikus módszerek alkalmazásával.
Az enantiomer tiszta anyagok szintézisére irányuló tendencia látható a monokirális gyógyszerek között. 1999 és 2003 között összesen 24 új bevezetésből 15 tiszta enantiomert kellett megállapítani, de a 2004 és 2008 közötti időszakban a szám 25 új bevezetésből 20 tiszta enantiomerre emelkedett. Ezek többnyire teljesen új anyagok, azaz enantiomerek, amelyek nem rendelkeznek racemát prekurzorokkal. A következő két 5 éves időszakban az enantiomer tiszta új fejlesztések aránya még mindig magas volt.
Néhány enantiomer gyógyszert azonban kifejlesztettek a nagy mennyiségű racemátok eutomerként való helyettesítésére. Egy enantiomer tiszta anyag azonban nem mindig nyújt valódi terápiás előnyt a racemáttal szemben. Kétséges, hogy a farmakológiailag aktív dexibuprofén [( S ) -enantiomer racém ibuprofen ], 2001-ben bevezetett, az igazi előre, mivel az ( R ) -enantiomer az ibuprofén gyors enzimatikusan átalakulnak az aktív ( S ) -forma után felszívódási akarat. A gyártó ajánlása szerint mind az enantiomer tiszta, mind a racém gyógyszert azonos módon kell adagolni. A 2000 -ben bevezetett köhögésgátló levodropropizin terápiás fölénye a racemát alkalmazásával szemben szintén megkérdőjelezhető, mivel nem volt világos különbség a hatékony és a nem hatékony enantiomer között, és mindkettőt hasonlóan adagolják. A szintén 2000 -ben bevezetett protonpumpa -gátló ezomeprazol, mint az achiralis aktív forma prodrugja, nincs erősebb hatása, mint az omeprazol ( R ) formája , de biológiailag jobban hozzáférhető a lassabb enzimatikus metabolizmus miatt . Mindazonáltal a protonpumpa -gátlók hatásmechanizmusa miatt a terápiás relevancia megkérdőjeleződött.
Másrészt az escitalopram , a levocetirizin , a levobupivakain és a dexrazoxán anyagok terápiás előrelépésnek minősülnek az előd racemátok hatékonyságához képest .
Egyes anyagok, a királis centrum nem a farmakológiailag aktív molekuláris tartományban, mint például a giráz inhibitorok gatifloxacin vagy nadifloxacin . Ekkor a racemát használatát indokolni kell.
Lásd még
irodalom
- EJ Ariëns: Sztereokémia, a farmakokinetika és a klinikai farmakológia kifinomult hülyeségeinek alapja . In: European Journal of Clinical Pharmacology . szalag 26 , nem. 6 , 1984, pp. 663-668 , doi : 10.1007 / BF00541922 .
- Adam Sobanski, Roland Schmieder, Fritz Vögtle : Topológiai sztereokémia és kiralitás . In: Kémia korunkban . szalag 34 , nem. 3 , 2000, pp. 160-169 , doi : 10.1002 / 1521-3781 (200006) 34: 3 <160 :: AID-CIUZ160> 3.0.CO; 2-6 .
- Klaus Roth : Egy soha véget nem érő kémiai történet . In: Kémia korunkban . szalag 39 , nem. 2005., 3. o. 212-217 , doi : 10.1002 / ciuz.200590038 .
- Bernard Testa: A szerves sztereokémia alapjai . Wiley-VCH, 1983, ISBN 3-527-25935-X .
- Uwe Meierhenrich: Aminosavak és az élet aszimmetriája . Springer-Verlag, 2008, ISBN 978-3-540-76885-2 .
web Linkek
Egyéni bizonyíték
- ↑ HJ Roth, CE Müller, G. Folkers (szerk.): Stereochemistry & Drugs: Basics - Consideration - Impact, Scientific Publishing Company mbH, Stuttgart, 80., 81., 1998.
- ↑ Wolfgang Legrum: Illatok, bűz és illat között , Vieweg + Teubner Verlag (2011), 33–35. O., ISBN 978-3-8348-1245-2 .
- ↑ Everhardus Ariëns : Sztereokémia, a farmakokinetika és a klinikai farmakológia kifinomult hülyeségeinek alapja , European Journal of Clinical Pharmacology 26 (1984) 663-668, doi : 10.1007 / BF00541922 .
- ↑ Nature (London) 385, 303 (1997).
- ↑ M. Reist, PA Carrupt, E. Francotte, B. Testa: A talidomid királis inverziója és hidrolízise: mechanizmusok és katalízis bázisok és szérumalbumin által, valamint a teratogén metabolitok királis stabilitása . In: Kémiai kutatások a toxikológiában . 11, 12, 1998, 1521-8. doi : 10.1021 / tx9801817 . PMID 9860497 .
- ↑ Bernd Engels, Carsten ékszerek , Tanja Schirmeister , Reinhold Fink: Kémia az egészségügyi szakemberek számára . ( google.de ).
- ^ Hermann J. Roth , Christa E. Müller és Gerd Folkers: Stereochemie & Arzneimittel , Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, ISBN 3-8047-1485-4 , 161-162.
- ↑ Duden: rectus .
- ↑ a b Hans-Dieter Jakubke, Hans Jeschkeit: aminosavak, peptidek, fehérjék , Verlag Chemie, Weinheim, 30. o., 1982, ISBN 3-527-25892-2 .
- ↑ a b H. J. Roth: Dex-, Lev-, Ar-, Es-, Rac-, új "tiszta" gyógyszerek-az elmúlt öt év mérlege . In: Deutsche Apothekerzeitung . szalag 149 , nem. 2009., 28. o. 3182-6 .
- ^ HJ Roth: Új királis gyógyszerek - mérleg a 2009–2013 közötti évekre . In: Deutsche Apothekerzeitung . Nem. 2014. 4. ( deutsche-apotheker-zeitung.de ).
- ↑ H. J. Roth: Királis kontra akirális gyógyszerek . In: Deutsche Apothekerzeitung . Nem. 2019. 6. ( deutsche-apotheker-zeitung.de ).
- ↑ a b c H. J. Roth: Dex-, Lev-, Es-, az elmúlt öt év mérlege: trend a tiszta enantiomerek alkalmazása felé . In: Deutsche Apothekerzeitung . szalag 144 , nem. 2004., 4. o. 2309 .