Toll-szerű receptorok
A toll-szerű receptorok (röviden TLR, angolul a toll-szerű receptor ) a veleszületett immunrendszer struktúrái (veleszületett immunitás), és a receptorok csoportjába tartoznak , a PRR - ek (Pattern-Recognition Receptors) . Ezeket a PAMP-k (Pathogen-Associated Molecular Patterns) felismerésére használják , amelyek kizárólag kórokozókon vagy azokban előforduló szerkezetek , és szabályozzák a gének megfelelő aktiválását . Ez aktiválja az "antigén-specifikus szerzett immunrendszert" (antigén-specifikus szerzett immunitás)kezdeményezett és modulált. A veleszületett védelmi rendszer képes megkülönböztetni az „én” és a „nem én” között az „útdíjszerű receptorokon” keresztül. A TLR -ket általában dendritikus sejtekben és makrofágokban fejezik ki, hámsejtekben alig vagy egyáltalán nem.
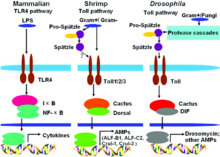
A név toll-like receptor (lásd a német nyelvű irodalomban jel transduction- közvetítésében PRR vagy ritkábban is, mint a toll-like receptor ) származik fehérje a Drosophila melanogaster , ami a kutatócsoport köré Nobel-díjas Christiane Nüsslein-Volhard volt annyira lelkesedett az volt, hogy viccesen nevezte nagy , szerint a német kifejezést . A pillanat, amely a gyümölcslégy nagy génjének nevét adta, az volt, amikor Eric Wieschaus kollégájával szemben ült egy kettős mikroszkópnál, amely lehetővé teszi két ember számára, hogy egyidejűleg megvizsgálják ugyanazt a tárgyat. „Egy nap, amikor megláttunk egy mutáns embriót, amelynek fejlődése ventralizált volt, mindketten teljesen meglepődtünk, és spontán„ nagyszerűnek ”kiáltottunk. Addig csak a dorsalis embriókat ismertük ”. A TLR-ek olyan fehérjékből állnak, amelyek Toll-ra hasonlítanak, azaz fizetősek .
Mióta az 1990-es évek közepén felfedezték az első autópálya-szerű receptorokat, emberekben és állatokban újra és újra új változatokat fedeztek fel. A TLR -ek minden gerincesben megtalálhatók , de olyan egyszerűbb szervezetekben is , mint a Drosophila melanogaster , ami arra utal, hogy ez egy evolúciós szempontból nagyon régi rendszer. A legtöbb fajnak több mint tíz különböző (ismert) TLR -je van. B. egérben fordulnak elő , de emberben nem.
A TLR -ek felismerik a vírusok , baktériumok és gombák különböző funkcionális összetevőit, és így biokémiai reakcióláncokat indíthatnak el a sejtekben , amelyek védekeznek ezekkel a kórokozókkal szemben.
A TLR -ek felfedezése
Amikor a mikroorganizmusokat először azonosították a fertőző betegségek okozójaként, egyértelmű volt, hogy a többsejtű organizmusoknak képesnek kell lenniük felismerni őket, és ennek érdekében fel kell ismerni a mikroorganizmusokra jellemző molekuláris szerkezeteket. A 20. század nagy részét átfogó szakirodalom nagy részét a kulcsmolekuláknak és azok receptorainak szentelik. Több mint 100 évvel ezelőtt Richard Pfeiffer , Robert Koch tanítványa megalkotta az „ endotoxin ” kifejezést, hogy olyan anyagot nevezzen meg, amelyet gram-negatív baktériumok termeltek, és amely lázhoz és sokkhoz vezetett állatkísérletekben. Az ezt követő évtizedekben az endotoxinokat kémiailag jellemezték és lipopoliszacharidokként (LPS) azonosították , amelyeket a legtöbb gram-negatív baktérium termel. Kimutatták, hogy más molekulák (bakteriális lipopeptidek, flagellinek és metilezetlen DNS ) szintén immunválaszhoz vezetnek . Logikusan ebből arra a következtetésre jutottak, hogy olyan receptoroknak kell lenniük, amelyek képesek immunválaszt kiváltani az ilyen molekuláris szerkezetekre. Ezeket azonban sok éven át nem találták meg.
A kilencvenes évek közepén a Drosophila melanogaster fejlődésbiológiájában végzett kutatás véletlenül fedezte fel , hogy a fizetős negatív mutánsok nagyon érzékenyek a gombatámadásra. Ez a megfigyelés megindította a hasonló fehérjék célzott keresését emlőssejtekben. 1994 -ben Nomura és munkatársai megtalálták az első emberi TLR -t, amelyet Taguchi és munkatársai 1996 -ban hozzá tudtak rendelni egy kromoszómához . Ez azt mutatja, hogy az autópályadíj-szerű receptorokon keresztül közvetített immunválasz egy evolúciós szempontból nagyon régi forma, amely genetikailag erősen konzervált. Mivel a TLR-ek immunvédelemben betöltött szerepe akkor még nem volt ismert, feltételeztük, hogy a TLR-1 szerepet fog játszani az emlősök fejlődési biológiájában. 1997-ben Charles Janeway és Ruslan Medzhitov kimutatták, hogy az autópályadíj-szerű receptor, ha mesterségesen kötődik a megfelelő antitestekhez, képes aktiválni bizonyos géneket, amelyek szükségesek az adaptív immunválaszhoz. A TLR-4 mint LPS receptor funkcióját Bruce A. Beutler és munkatársai fedezték fel . Idővel meghatározták a többi TLR ligandjait is. Ebben központi szerepet játszott Shizuo Akira .
Szerkezet és ligandumok
Valamennyi fizetős típusú receptor közös szerkezeti jellemzői az N-terminális leucinban gazdag LRR szekvenciák ( Leucinban gazdag ismétlődések ) és a TIR domén (Toll / IL-1R homológia domén) . A különböző TLR -ek mindegyike különböző PAMP -kat (Pathogen Associated Molecular Patterns) azonosíthat a kórokozó megfelelő membránfelületével való közvetlen kölcsönhatás révén . A TLR-3, TLR-7, TLR-8 és TLR-9 az endoszómák vagy az endolizoszómák membránján helyezkednek el , míg a fennmaradó vámszerű receptorok a sejtmembránon találhatók.
A TLR-2 felismeri a baktériumok, mikoplazmák, gombák és vírusok számos összetevőjét. Ide tartoznak a baktériumok és a mikoplazmák lipoproteinek is. Az észlelés úgy történik, hogy a TLR2 heterodimert képez TLR1 -gyel vagy TLR6 -val. A kapott TLR-1 / TLR-2 és TLR-6 / TLR-2 komplexek felismerik a triacil- és diacil-lipoproteineket. A TLR2 aktiválása számos citokin felszabadulásához vezet . Az alfa-interferon (IFN-α) csak részben szabadul fel. Általában feltételezik, hogy az IFN-α felszabadulása a sejttípustól függ. A TLR-10 primer szerkezetében (szekvenciaegyezése) hasonló a TLR-1-hez és a TLR-6-hoz, de a ligandum még nem ismert. A TLR-4 felismeri a lipopoliszacharidot (LPS) a sejtfelszínen az MD2-vel (myeloid differenciálódási faktor 2) együtt . Az LPS a gram-negatív baktériumok külső membránjából származó anyag, és állatmodellekben használják az akut fertőzések korlátozott szimulációjára. Az LPS észlelésében két TLR4-MD2-LPS komplex együttesen alkot egy TLR4 homodimert.
A TLR5 főként a lamina propriában expresszálódik , ahol felismeri a bakteriális flagellint. Immunválaszként a TLR-5 indukálja a B-sejtek differenciálódását IgA-termelő vérsejtekké és a T-sejteket antigén-specifikus Th17- és Th1-sejtekké. A TLR-11, amely csak egerekben fordul elő, de emberekben nem, nagy hasonlóságot mutat a TLR-5-tel. Felismer egy profilinszerű molekulát, amely az intracelluláris protozoon Toxoplasma gondii- ból származik . Számos TLR, köztük TLR-3, TLR-7, TLR-8 és TLR-9 felismeri a vírusokból vagy baktériumokból származó nukleinsavakat. Ezen TLR -ek aktiválása alfa -interferon és más gyulladásos citokinek képződéséhez vezet . A TLR-3 vírus kettős szálú RNS-t észlel az endolizoszómában. A dsRNS az LRR szekvencia N-terminálisához és C-terminális végéhez kötődik .
| receptor | Ligandok | A ligandumok eredete | A TLR adapterfehérje | Sejtes lokalizáció | Sejt típusok |
|---|---|---|---|---|---|
| TLR-1 | Különféle triacil -lipopeptidek | Bakteriális lipoprotein | MyD88 / MAL | A sejt felülete |
|
| TLR-2 | Különféle glikolipidek | Bakteriális peptidoglikánok | MyD88 / MAL | A sejt felülete |
|
| Különféle lipopeptidek és proteolipidek | Bakteriális peptidoglikánok | ||||
| Lipoteichoinsav | Gram -pozitív baktériumok | ||||
| HSP70 | Gazdasejtek | ||||
| Zymosan ( béta-glükán ) | gombát | ||||
| Számos más | |||||
| TLR-3 | Két szálú RNS , poli I: C | Vírusok | TRIF | Cella rekesz |
|
| TLR-4 | Lipopoliszacharid , eritorán | Gram -negatív baktériumok | MyD88 / MAL / TRIF / TRAM | A sejt felülete |
|
| Több hősokk fehérje | Baktériumok és gazdasejtek | ||||
| Fibrinogén | Gazdasejtek | ||||
| Heparán -szulfát -töredékek | Gazdasejtek | ||||
| Hialuronsav töredékek | Gazdasejtek | ||||
| nikkel | |||||
| Különféle opioidok | |||||
| TLR-5 | Bakteriális flagellin | baktériumok | MyD88 | A sejt felülete |
|
| Profilin | Toxoplasma gondii | ||||
| TLR-6 | Különböző diacil -lipopeptidek | Mycoplasma | MyD88 / MAL | A sejt felülete |
|
| TLR-7 | Imidazoquinolin | Kis molekulatömegű szintetikus anyagok | MyD88 | Cella rekesz |
|
| Loxoribin ( guanozin analóg ) | |||||
| Bropirimine | |||||
| Imiquimod , resiquimod | |||||
| Egyszálú RNS | RNS vírusok | ||||
| TLR-8 | Alacsony molekulatömegű szintetikus anyagok, RNáz-feldolgozott vírusos és bakteriális RNS, resiquimod | MyD88 | Cella rekesz |
|
|
| TLR-9 | Nem metilezett CpG oligonukleotidok (DNS) | Baktériumok, DNS -vírusok | MyD88 | Cella rekesz |
|
| TLR-10 | Triacilált lipopeptidek | ismeretlen | A sejt felülete |
|
|
| TLR-11 | Profilin | Toxoplasma gondii | MyD88 | Cella rekesz |
|
| TLR-12 | Profilin | Toxoplasma gondii | MyD88 | Cella rekesz |
|
| TLR-13 | Bakteriális riboszómális RNS -szekvencia CGGAAAGACC (metilezetlen) | Vírusok, baktériumok | MyD88, TAK-1 | Cella rekesz |
|
Az intracelluláris jel kaszkád
A komplement rendszer "C3a" és "C5a" kémiatraktor fehérjéi a C3 és C5 inaktív prekurzorokból származó proteolitikus hasítás révén keletkeznek. Aktivált csalik makrofágok és neutrofil granulociták . Ezeknek a fagocitáknak a felületén TLR típusú receptorok vannak. A TLR -ek reagálnak bakteriális proteoglikánokra vagy lipopoliszacharidokra (LPS), DNS -re és RNS -re. Jelző kaszkádot váltanak ki hordozósejtjeikben, ami végső soron serkenti a fertőzés elleni védekezést. Miután felismerte ezeket a bakteriális felületi struktúrákat az extracelluláris oldalon, a sejten belüli szignál kaszkádokat TLR váltja ki.
A PAMP -k (Pathogen Associated Molecular Patterns) TLR -ek általi felismerése bizonyos gének transzkripciós sebességének növekedéséhez vezet, attól függően, hogy mely TLR -ek és mely sejttípusok érintettek. Az egyes TLR-ek által aktivált jel-kaszkádok közötti különbség legalább részben a TIR domént tartalmazó adaptermolekulákkal (TIR domént tartalmazó adaptermolekulákkal) magyarázható. Öt TIR domént tartalmazó adaptermolekula létezik, köztük a MyD88, a TRIF / TICAM-1 (IFN-β-t indukáló TIR-domént tartalmazó adapter), a TIRAP / Mal, a TRAM (a TRIF-hez kapcsolódó adaptermolekula) és a SARM (steril alfa és Armadillo motívumot tartalmazó fehérje). A TLR jelláncok nagyjából két különböző reakcióláncra oszlanak, a MyD88 és a TRIF adaptermolekulák részvételétől függően.
Ez foszforilációhoz és ezáltal az intracelluláris kinázok aktiválásához vezet, amelyek feladata a transzkripciós faktorok intracelluláris inhibitorainak foszforilezése . Először is, a MyD88 adapterfehérje kötődik a TLR citoplazmatikus szakaszához. Ennek eredményeként az IL-1 receptorhoz kapcsolódó kináz (IRAK) most a MyD88-hoz kötődik, és autofoszforiláció útján aktiválja magát. További egyedi lépésekben aktiválódik az NF-κB transzkripciós faktor , amely ezután a sejtmagba transzlokálódik és ott kifejezi azt Szabályozza a TNFα, IL-1, IL-12 és E-szelektin génjeit.
irodalom
- K. Takeda, S. Akira: Toll-szerű receptorok a veleszületett immunitásban. In: International immunology , 17. kötet, 1. szám, 2005. január, ISSN 0953-8178 , 1-14. O. , Doi: 10.1093 / intimm / dxh186 , PMID 15585605 (recenzió).
- Luke AJ O'Neill: Az immunológiai korai figyelmeztető rendszer. Spectrum of Science , 2005. augusztus, 68–75
- SE Turvey, TR Hawn: A finomság felé: a Toll-szerű receptor jelzés szerepének megértése az emberi fertőzésekre való hajlamban. In: Klinikai immunológia (Orlando FL), 120. kötet, 1. szám, 2006. július, ISSN 1521-6616 , 1-9. O. , Doi: 10.1016 / j.clim.2006.02.003 , PMID 16563867 (felülvizsgálat).
- Nicola Siegmund-Schultze: Deutsches Ärzteblatt: Toll-szerű receptorok: Az immunstimuláló gyógyszerek új célstruktúrája . In: Deutsches Ärzteblatt . szalag 104 , nem. 16 . Deutscher Ärzte-Verlag, 2007. április 20., p. A-1072 / B-954 / C-908 .
Egyéni bizonyíték
- ↑ a b c d Peter Fritsch: Dermatology and Venereology . 2. kiadás. Springer Verlag, 2004, ISBN 3-540-00332-0 .
- ↑ Díjszerű Receptor , német. Doktor Bl 2007; 104 (16): A-1072 / B-954 / C-908. Letöltve: 2020. június 8.
- ↑ B. Lemaitre, J. Hoffmann: A Drosophila melanogaster gazdavédelme . In: Az immunológia éves áttekintése . 25, 2007, 697-743. doi : 10.1146 / annurev.immunol.25.022106.141615 . PMID 17201680 .
- ↑ S. Valanne, JH Wang, M. Rämet: The Drosophila Toll signaling pathway . In: Journal of Immunology . 186., 2. szám, 2011. január, 649-656. doi : 10.4049 / jimmunol.1002302 . PMID 21209287 .
- ↑ JP Dudzic, MA Hanson, I. Iatsenko, S. Kondo, B. Lemaitre: Több, mint fekete vagy fehér: Melanizáció és fizetős részvények A szabályozó szerinproteázok megosztása a Drosophilában . In: Cell Reports . 27., 4. szám, 2019. április, 1050-1061. O. doi : 10.1016 / j.celrep.2019.03.101 . PMID 31018123 .
- ^ MA Hanson, PT Hamilton, SJ Perlman: Immungének és eltérő antimikrobiális peptidek a Drosophila alnemben legyekben . In: BMC Evolúciós Biológia . 16., 1. szám, 2016. október, 228. o. Doi : 10.1186 / s12862-016-0805-y . PMID 27776480 .
- ↑ B. Lemaitre, E. Nicolas, L. Michaut, JM Reichhart, JA Hoffmann : A dorsoventralis szabályozó génkazetta spätzle / Toll / kaktusz szabályozza a Drosophila felnőttek erős gombaellenes válaszát. In: Cell . 86. kötet, 6. szám, 1996. szeptember, ISSN 0092-8674 , 973-983, PMID 8808632 .
- ↑ T. Kawai, S. Akira: A mintafelismerő receptorok szerepe a veleszületett immunitásban: frissítés a Toll-szerű receptorokról. In: Természetimmunológia . 11. kötet, 5. szám, 2010. május, 373-384. O., Doi: 10.1038 / ni.1863 , PMID 20404851 (felülvizsgálat).
- ↑ a b c A forrás, hacsak a táblázat bejegyzései másképp nem jelzik : C. Waltenbaugh, T. Doan, R. Melvold, S. Viselli: Immunology (= Lippincott's Illustrated reviews). Wolters Kluwer Health / Lippincott Williams & Wilkins, Philadelphia 2008, ISBN 978-0-7817-9543-2 , 17. o.
- ↑ a b I. Sabroe, SK Dower, MK Whyte: A Toll-szerű receptorok szerepe a neutrofilek migrációjának, aktiválásának és apoptózisának szabályozásában . In: Klinikai fertőző betegségek . 41 Suppl 7, 2005. november, S421-426. doi : 10.1086 / 431992 . PMID 16237641 .
- ↑ a b c d F. Sallusto, A. Lanzavecchia: A dendritikus sejtek tanulságos szerepe a T-sejt válaszokban . In: Arthritis Research . 4 Suppl 3, 2002, S127-132. doi : 10.1186 / ar567 . PMID 12110131 . PMC 3240143 (ingyenes teljes szöveg).
- ↑ CF Nicodemus, JS Berek: TLR3 agonisták, mint immunterápiás szerek. In: Immunoterápia. 2. kötet, 2. szám, 2010. március, 137-140. O. , Doi: 10.2217 / imt.10.8 , PMID 20635920 .
- ↑ KA Shirey, W. Lai és munkatársai: A TLR4 antagonista Eritoran megvédi az egereket a halálos influenzafertőzéstől. In: Természet. 497. kötet, 7450. szám, 2013. május, ISSN 1476-4687 , 498-502 . O., Doi: 10.1038 / nature12118 , PMID 23636320 , PMC 3725830 (ingyenes teljes szöveg).
- ^ EJ Hennessy, AE Parker, LA O'Neill: Toll-szerű receptorok célzása: feltörekvő terápiák? In: Természeti vélemények. Kábítószer -felfedezés. 9. kötet, 4. szám, 2010. április, ISSN 1474-1784 , 293-307. O., Doi: 10.1038 / nrd3203 , PMID 20380038 (felülvizsgálat).
- ↑ S. Gerondakis, RJ Grumont, A. Banerjee: A B-sejtek aktivációjának és túlélésének szabályozása a TLR jelekre adott válaszként . In: Immunológia és sejtbiológia . 85, 6. szám, 2007, 471-475. doi : 10.1038 / sj.icb.7100097 . PMID 17637697 .
- ^ E. Cario, IM Rosenberg, SL Brandwein, PL Beck, HC Reinecker, DK Podolsky: A lipopoliszacharid aktiválja a különböző jelátviteli utakat a bélhámsejtvonalakban, amelyek Toll-szerű receptorokat expresszálnak . In: Journal of Immunology . 164., 2. szám, 2000. január, 966-972. doi : 10.4049 / jimmunol.164.2.966 . PMID 10623846 .
- ↑ M. Peana, K. Zdyb, S. Medici, A. Pelucelli, G. Simula, E. Gumienna-Kontecka, MA Zoroddu: Ni (II) kölcsönhatás a humán TLR4 ektodomén peptidmodelljével . In: Journal of Trace Elements in Medicine and Biology . 44., 2017. december, 151-160. doi : 10.1016 / j.jtemb.2017.07.006 . PMID 28965571 .
- ↑ RM Salazar Gonzalez, H. Shehata, MJ O'Connell, Y. Yang, ME Moreno-Fernandez, CA Chougnet, J. Aliberti: A Toxoplasma gondii-ből származó profilin kiváltja az emberi toll-szerű receptor 5-függő citokin termelést . In: Journal of Inside Immunity . 6., 2014. 5. szám, 685-694. doi : 10.1159 / 000362367 . PMID 24861338 . PMC 4141014 (ingyenes teljes szöveg).
- ↑ Thomas Ostendorf, Thomas Zillinger, Katarzyna Andryka, Thais Marina Schlee-Guimaraes, Saskia Schmitz: A szintetikus, bakteriális és protozoon RNS immunérzékelése a Toll-szerű 8-as receptortól az RNase T2 és az RNase 2 összehangolt feldolgozását igényli . In: Immunitás . szalag 52 , nem. 2020. április 4 . 591–605.e6 , doi : 10.1016 / j.immuni.2020.03.009 ( elsevier.com [letöltve: 2020. szeptember 18.]).
- ↑ C. Maisonneuve, S. Bertholet et al.: A NOD és a Toll-szerű agonisták, mint vakcinaadjuvánsok potenciáljának felszabadítása. In: Proceedings of the National Academy of Sciences . 111. kötet, 34. szám, 2014. augusztus, ISSN 1091-6490 , 12294-12299, doi: 10.1073 / pnas.1400478111 , PMID 25136133 , PMC 4151741 (ingyenes teljes szöveg) (áttekintés).
- ↑ Y. Guan, DR Ranoa, S. Jiang, SK Mutha, X. Li, J. Baudry, RI Tapping: A humán TLR 10 és 1 közös mechanizmusai a veleszületett immunérzékelésnek, de nem jelzés . In: Journal of Immunology (Baltimore, Md.: 1950) . 184., 9. szám, 2010. május, 5094-5103. doi : 10.4049 / jimmunol.0901888 . PMID 20348427 .
- ↑ T. Chuang, RJ Ulevitch: A hTLR10 azonosítása: új humán Toll-szerű receptor, amelyet előnyösen immunsejtekben expresszálnak . In: Biochimica Et Biophysica Acta . 1518, 1-2. Szám, 2001. március, 157-161. doi : 10.1016 / s0167-4781 (00) 00289-x . PMID 11267672 .
- ^ V. Hornung, S. Rothenfusser, S. Britsch, A. Krug, B. Jahrsdörfer, T. Giese, S. Endres, G. Hartmann: A toll-like receptor 1-10 mRNS kvantitatív kifejeződése az emberi perifériás sejtek alcsoportjaiban a vér mononukleáris sejtjei és a CpG oligodeoxinukleotidokkal szembeni érzékenység . In: Journal of Immunology . 168., 9. szám, Baltimore, Md .: 1950, 2002. május, 4531-4537. doi : 10.4049 / jimmunol.168.9.4531 . PMID 11970999 .
- ^ A b T. Regan, K. Nally, R. Carmody, A. Houston, F. Shanahan, J. MacSharry, E. Brint: azonosítása TLR10 kulcsfontosságú mediátora a gyulladásos válasz Listeria monocytogenes intestinalis epithelialis sejtekben és makrofágok . In: Journal of Immunology . 191, 12. szám, 2013. december, 6084-6092. doi : 10.4049 / jimmunol.1203245 . PMID 24198280 .
- ↑ F. Yarovinsky, D. Zhang, JF Andersen, GL Bannenberg, CN Serhan, MS Hayden, S. Hieny, FS Sutterwala, RA Flavell, S. Ghosh, A. Sher: A dendritikus sejtek TLR11 aktiválása protozoon profilin-szerűen fehérje . In: Tudomány . 308., 5728. szám, 2005. június, 1626-1629. irányítószám : 2005Sci ... 308.1626Y . doi : 10.1126 / science.1109893 . PMID 15860593 .
- ↑ R. Pifer, A. Benson, CR Sturge, F. Yarovinsky: Az UNC93B1 elengedhetetlen a TLR11 aktiválásához és az IL-12-függő gazda Toxoplasma gondii elleni rezisztenciájához . In: The Journal of Biological Chemistry . 286., 5. szám, 2011. február, 3307-3314. doi : 10.1074 / jbc.M110.171025 . PMID 21097503 . PMC 3030336 (ingyenes teljes szöveg).
- ↑ AA Koblansky, D. Jankovic, H. Oh, S. Hieny, W. Sungnak, R. Mathur, MS Hayden, S. Akira, A. Sher, S. Ghosh: A profilin Toll-like receptor 12 általi felismerése kritikus a gazda Toxoplasma gondii elleni rezisztenciájára . In: Immunitás . 38., 1. szám, 2013. január, 119-130. doi : 10.1016 / j.immuni.2012.09.016 . PMID 23246311 . PMC 3601573 (ingyenes teljes szöveg).
- ↑ BB Mishra, UM Gundra, JM Teale: Toll-szerű receptorok 11-13 kifejeződése és eloszlása az agyban egér neurocysticercosis során . In: Journal of Neuroinflammation . 2008. december 5., 53. o. Doi : 10.1186 / 1742-2094-5-53 . PMID 19077284 . PMC 2631477 (ingyenes teljes szöveg).
- ↑ Z. Shi, Z. Cai, A. Sanchez, T. Zhang, S. Wen, J. Wang, J. Yang, S. Fu, D. Zhang: Egy új Toll-szerű receptor, amely felismeri a vezikuláris stomatitis vírust . In: The Journal of Biological Chemistry . 286., 6. szám, 2011. február, 4517-4524. doi : 10.1074 / jbc.M110.159590 . PMID 21131352 . PMC 3039399 (ingyenes teljes szöveg).
- ↑ M. Oldenburg, A. Krüger, R. Ferstl, A. Kaufmann, G. Nees, A. Sigmund, B. Bathke, H. Lauterbach, M. Suter, S. Dreher, U. Koedel, S. Akira, T Kawai, J. Buer, H. Wagner, S. Bauer, H. Hochrein, CJ Kirschning : A TLR13 felismeri a bakteriális 23S rRNS-t, amely nem tartalmaz eritromicin rezisztenciaképző módosítást . In: Tudomány . 337. szám, 6098, 2012. augusztus, 1111-1115. irányítószám : 2012Sci ... 337.1111O . doi : 10.1126 / science.1220363 . PMID 22821982 .
- ↑ H. Hochrein, CJ Kirschning: A baktériumok elkerülik az immunfelismerést a TLR13 -on keresztül, és 23S rRNS -ük kötődését az MLS antibiotikumok által ugyanazokkal a mechanizmusokkal . In: Onkoimmunológia . 2., 3. szám, 2013. március, E23141. doi : 10.4161 / onci.23141 . PMID 23802068 . PMC 3661153 (ingyenes teljes szöveg).