Elektrofil adagolás
Az elektrofil addíció (A E ) a szerves kémia kémiai reakciója , amelyben a telítetlen szénhidrogének ( alkének vagy alkinek ) különböző anyagosztályokkal reagálnak. Az elektrofil addíciók közös jellemzője, hogy a reakciót egy elektronszerető részecske, az elektrofil támadása indítja el a kettős vagy hármas kötésre, pontosabban a π kötésre.
Hozzáadás a C = C kettős kötéshez
Halogének hozzáadása az alkénekhez
Molekuláris halogének adhatók az alkének kettős kötéséhez kétlépéses mechanizmusban . A halogénmolekula kölcsönhatásba lép az alkén kettős kötésével, aminek következtében a halogénmolekula polarizálódik, és az elektronkötés heterolitikusan szétesik . Az első lépésben halónium-iont (itt példaként: brónium-iont (Br + )) adunk a szénatom kettős kötéséhez , amelyben rövid élettartamú ciklikus kationt képez, miközben kettős kötést hasít . A második lépésben a halogenidion (itt: bromidion ) nukleofil módon megtámadja a pozitív töltésű szénatomot, és így telített α, β-dihalogenált terméket kapunk.
A halogének hozzáadása a klór , bróm és jód elemekre korlátozódik . A molekuláris fluor viszont nagyon reaktív, és szelektíven támadja a CC és CH kötéseket. A klór elektronegatívabb és kevésbé polarizálható, mint a bróm és a jód. Emiatt a klór hozzáadása egy karbokationos közbenső szakaszon keresztül történik , amelyet nem stabilizál egy ciklikus (nem létező) klóriumszerkezet.
A stabilizált kationok képződése, ahogy a bróm és a jód hozzáadása esetén is előfordul, meghatározza a képződött dihalid sztereokémiáját . Ez hatékonyan megvédi a molekula egyik oldalát a nukleofil támadásoktól, így a támadás csak az ellenkező oldalról történhet meg. Az egyik itt egy anti-addícióról beszél . Ennek eredményeként a bróm és a jód hozzáadása nagy szelektivitású anti -termék képződéséhez vezet .
Hidrogén -halogenidek hozzáadása
Szintén hidrogén-halogenideket is adhatunk alkének, amelyek halogén-alkánok képződnek. Ez a kiegészítés is két szakaszban történik. Első lépésben a felhasznált sav protonja növeli a kettős kötést. A halóniumionokkal ellentétben a proton nem képes stabilizálni a pozitív töltést, ezért karbokation képződik. A második lépésben ehhez hozzáadjuk a sav anionját .
Ezzel a kiegészítéssel két különböző termék képződhet, amelyek a halogén helyzetében különböznek. Az, hogy a termékek közül melyik képződik előnyben, a közbenső karbokation stabilizációjától függ, és ezt Markovnikov szabálya írja le , amely szerint a hidrogénatom mindig ahhoz a szénatomhoz kötődik, amely már hidrogénben gazdagabb. A terméket előnyösen úgy alakítjuk ki, hogy jobban stabilizálható legyen. Általában a stabilabb karbokation a fokozottan alkilezett . A kiindulási anyagtól függően ebben a reakcióban nagy regioszelektivitás érhető el .
Alkoholok alkénekből
Víz hozzáadása az alkénekhez
A víz rossz nukleofil , ezért az alkének vízzel való reakciója általában nem vezet a várt reakciótermékhez, egy alkoholhoz . A reakció azonban savas katalízis alatt megy végbe. Amint azt korábban leírtuk, az első lépésben a sav protonját adjuk a kettős kötéshez. A képződött karbokation mára kellően elektrofil egy vízmolekula nukleofil támadásához. Az adagolás után ez lehasad egy protont, másodlagos alkoholt képezve.
Ha maga a sav anionja nukleofil, az anion versenyez a vízmolekulával a karbokation hozzáadása miatt (lásd még az előző részt).
A diolok szintézise
A víz hozzáadása a kettős kötésekhez alkoholokat eredményez, de a diolok nem szintetizálhatók ilyen módon . Ez szervetlen oxigénvegyületek , például kálium -permanganát vagy ozmium -tetroxid hozzáadásával lehetséges . Első lépésben az oxigénhordozó hozzáadja az alként, a második lépésben a köztes terméket hidrolizálják , ami felszabadítja a diolt.
A 2001 , Barry Sharpless-ben elnyerte a kémiai Nobel-díjat a fejlődés egy sztereo dihidroxilezés .
→ lásd még a fő cikket: Dihidroxilezés
Konjugált kettős kötés hozzáadása
A konjugált kettős kötésekhez való hozzáadás ugyanazokat a szabályokat követi, mint a fent ismertetett izolált kettős kötésekhez való hozzáadást. Figyelembe kell azonban venni, hogy az első lépésben képződő karbokation mezomer módon stabilizálható. Ez a stabilizáció elosztja a pozitív töltést több szénatomra, ami azt jelenti, hogy a nukleofil különböző pozíciókban támadhat. Általában mindkét termék keverékét kapjuk ilyen reakciók során.
Adalék az alkinekhez
Az alkének hozzáadásával analóg módon az alkinok hármas kötéséhez is adhatunk hozzá. Mechanikailag ezek az alkének hozzáadásával analóg módon történnek. Első lépésben egy elektrofil megtámadja a hármas kötést, és vinil -kationt hoz létre . A második lépésben egy meglévő nukleofil megtámadja a kationos helyzetet. Ez helyettesített alként hoz létre. Ez egy második addíciós reakcióban tovább reagálhat a megfelelő alkán képződésére .
Ha az első adagolás során elektron-elvonó csoportokat, például halogénatomokat vezettek be, a második addíció lényegesen lassabban megy végbe, mert a kettős kötés elektronsűrűsége csökken. A reakció gyakran leállítható az első adagolás után az alkén fázisban.

A sav-katalizált víz hozzáadásával, hogy alkinek hozamok enolok . Ezek tautomerizálódnak a ketonok ( keto-enol tautoméria ), ezért a víz hozzáadásával alkinek a lehetősége szintéziséhez ketonok.
Adalék a karbonilokhoz
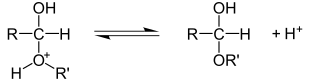
Addíciós reakciók is végrehajthatjuk a karbonil-csoportok . A CC kötések hozzáadásával ellentétben a CO kötés mindig polarizált a szénhez képest nagyobb elektronegativitás miatt. A nukleofilek ezért mindig megtámadják az elektronszegény szénatomot, következésképpen az elektrofilek reagálnak az oxigénatommal. Egy példa az elektrofil Amellett, hogy egy karbonil-csoport kialakulását acetálok a ketonok vagy aldehidek . Első lépésben a karbonil -oxigént sav segítségével protonálják. Ez pozitív töltést hoz létre a karbonil -szénen, amelyet egy alkohol nukleofil módon megtámad a második lépésben. A félacetál felszabadul a protonnak az előző alkoholon való szétválasztásával.
irodalom
- Peter Sykes: Hogyan működnek a szerves reakciók? 2. kiadás. Wiley-VCH 2001, ISBN 3-527-30305-7 .
- Marye Anne Fox, James K. Whitesell: Szerves kémia, alapok, mechanizmusok, bioorganikus alkalmazások. Spektrum, Akad. Verlag, 1995, ISBN 3-86025-249-6 .