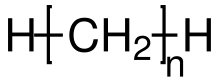Alkánok
A szerves kémiában az alkánok ( határ szénhidrogének , korábban paraffinok ) a telített , aciklikus szénhidrogének csoportja . Vagyis képviselőik csak a két elemből állnak: szén (C) és hidrogén (H), csak egyetlen kötésük van és nincsenek széngyűrűik. Ez az alifás szénhidrogének alcsoportjává teszi őket . Azokra a C n H 2 n +2 általános képlet vonatkozik, amelyek n = 1, 2, 3, ... n = 4 -től az alkánok alapszerkezete elágazó (lineáris) vagy elágazó szénláncokból állhat. Az el nem ágazó vegyületeket n -alkánoknak nevezik, és alkánok homológ sorozatát alkotják. Az elágazó láncú alkánokat izoalkánoknak ( i -alkánoknak) nevezik .
A telített ciklikus szénhidrogének általános általános empirikus képlettel rendelkeznek, és a cikloalkánok csoportját képezik, és ott ismertetik őket.
n -alkánok
A legegyszerűbb alkán a metán . Az első tizenkét n -alkánt a következő táblázat tartalmazza. Ezek alkotják az alkánok homológ sorozatát .
| C. | Vezetéknév | Molekuláris képlet | Moláris tömeg | Olvadáspont | forráspont | sűrűség | Labda és bot modell |
|---|---|---|---|---|---|---|---|
| 1 | metán | CH 4 | 16,04 g mol -1 | 90,65 K | 111,4 K | 0,72 kg / m 3 gázhalmazállapotú 0,42 g / cm 3 folyadék |
|
| 2 | Etán | C 2 H 6 | 30,07 g mol -1 | 90 K | 185 K | 1,36 kg / m 3 0,54 g / cm 3 |
|
| 3 | propán | C 3 H 8 | 44,10 g mol -1 | 85 K | 231 K | 2,01 kg / m 3 0,58 g / cm 3 |
|
| 4. | n -Bután | C 4 H 10 | 58,12 g mol -1 | 135 K | 272,5 K | 2,71 kg / m 3 0,60 g / cm 3 |
|
| 5 | n -pentán | C 5 H 12 | 72,15 g mol -1 | 144 K | 309 K | 0,626 g / cm 3 | |
| 6. | n -hexán | C 6 H 14 | 86,18 g mol -1 | 178 K | 342 K | 0,659 g / cm 3 | |
| 7 | n -heptán | C 7 H 16 | 100,2 g mol -1 | 182 K | 371 K | 0,684 g / cm 3 | |
| 8. | n- oktánszám | C 8 H 18 | 114,2 g mol -1 | 216 K | 399 K | 0,703 g / cm 3 | |
| 9 | n -Nonán | C 9 H 20 | 128,3 g mol -1 | 222 K | 424 K | 0,718 g / cm 3 | |
| 10 | n -dekáns | C 10 H 22 | 142,3 g mol -1 | 243 K | 447 K | 0,73 g / cm 3 | |
| 11 | n -Undekán | C 11 H 24 | 156,3 g mol -1 | 248 K | 469 K | 0,74 g / cm 3 | |
| 12 | n -dodekán | C 12 H 26 | 170,3 g mol -1 | 263 K | 489 K | 0,75 g / cm 3 |
i -alkánok
|
|
| n -Bután | izo- bután (metil-propán) |
A szénatomok számának növekedésével növekszik kovalens kötésük lehetősége is . Ezért fordul elő, hogy a propánnál magasabb szénatomszámú összes alkán nagyszámú alkotmányos izomerben fordul elő - molekulák azonos empirikus képlettel, de eltérő szerkezetűek ( felépítésűek ). Ezeket izomereknek nevezik .
A bután esetében , ugyanazzal a C 4 H 10 empirikus képlettel , két lehetséges elrendezés lehetséges az alkánmolekula szénatomjaira. Bután létezik két különböző alkotmányok: n- bután és izo- bután ( izomer bután ). Az izo -alkánok - röviden i -alkánok - kifejezés innen származik.
Pentán már akkor bekövetkezik, három különböző alkotmányok, a n alkán egy egyenes láncú molekula, az izo- pentán egyik ág a második szénatom, és a neo- pentán két ága a második szénatom.
A szénatomok számának növekedésével növekszik a lehetséges izomerek száma is, amelyek nagy része azonban csak elméletileg létezik - a természetben és a technológiában csak néhánynak van jelentősége (lásd alább az alkánok izomerjeinek számát ). A húsz szénatomos láncú Icosan (korábban Eicosan) már 366 319 különböző alkotmányos izomert tartalmaz. A 167 szénatomos alkánok esetében az elméletileg lehetséges izomerek száma meghaladja a látható univerzumban lévő részecskék becsült számát.
A hosszú láncú, elágazó láncú alkánokat izoparaffinoknak is nevezik .
Alkán sztereokémia
Elágazó láncú alkánok lehetnek királisak ; H. Ugyanazzal az alkotmánnyal különböző tükörfordított elrendezések lehetségesek. Például 3-metil-hexán esetében ez a 3. pozícióban lévő szénnél fordul elő. Ez biológiailag lényeges számos biomolekulában. A klorofill oldallánca , mint a tokoferol ( E -vitamin ), elágazó királis alkán. Királis alkánok lehet elválasztani a saját enantiomerekre által enantioszelektív gázkromatográfiával .
elnevezéstan
Az alkánok nómenklatúráját pontosan meghatározza a Tiszta és Alkalmazott Kémia Nemzetközi Szövetsége (IUPAC).
Minden törzsnév -an végződésű . Ezt a befejezést egy görög szám előzi meg, amely a szénatomok számát jelzi. Az első négy alkán esetében ezek triviális nevek , a metán, etán (korábban etán), propán és bután elnevezéseket történelmi okokból adták meg. A tíz szénnél nagyobb szénatomszámú alkánok elnevezésének módja megtalálható a cikk nómenklatúrájában .
Az elágazó alkánokra a következő elnevezési szabályok vonatkoznak:
- A leghosszabb folytonos szénlánc szénatomjai úgy vannak számozva, hogy a tercier vagy kvaterner szénatomok mindegyike a lehető legkisebb számot kapja. Ez az az eset, amikor mindezen számok összege a legkisebb (a fenti példa molekula: 2 + 3 + 4 = 9). A molekula ennek a leghosszabb láncnak megfelelően kapja a törzsnevet (a fenti példa molekula: 6 szénatom → hexán ).
- Az elágazó alkilcsoportok (oldalláncok) nevét szintén hosszuk határozza meg, és az alkán alapneve elé kerülnek betűrendben növekvő sorrendben (lásd a 4. kiegészítő a szabályt).
- Ezeket az alkilcsoport neveket a szénatomok száma előzi meg, amelyeknél elágaznak, kötőjellel elválasztva tőlük (lásd az 5. kiegészítő b szabályt).
- Kiegészítő szabály a) Ha több azonos nevű alkilcsoport ágazik le a fő láncról, akkor ezeket az alkilcsoport neveket görög jelöléssel ( di = kettő, tri = három stb.) Előzi meg számszerű szóként. Meg kell jegyezni, hogy ezeket a számszerű szavakat nem veszik figyelembe az ábécé szerinti rendezésnél.
- További szabály b) Ha több elágazó alkilcsoport van azonos nevű, akkor a számokat vesszővel elválasztva, növekvő értékkel jelezzük. Ha két azonos alkilcsoport elágazik egy kvaterner szénatomból, akkor a szénatom számát kétszer jegyezzük fel.
Példa az a) és b) kiegészítő szabályokra a 3-etil-2,2,4-trimetil-hexán: A fent bemutatott 3-etil-2,4-dimetilhexánban a második szénatom hidrogénatomja helyébe egy metil-csoport . Megjegyzés: Az említett két vegyület mindegyikének több királis központja van , így ez a nómenklatúra hiányos.
A múltban az alkánokat „korlátozó szénhidrogéneknek” vagy paraffinoknak nevezték . Ez utóbbi a latin parum affinis -ből származik , ami „kevés rokonnak ” minősül - korábban azt hitték, hogy az egymással reagáló anyagoknak valamilyen „rokonsággal” kell rendelkezniük -, és így kifejezték e vegyületek relatív tehetetlenségét. Ma a név általában csak bizonyos szilárd alkánok keverékére utal .
Alkilcsoport
Ha egy alkánmolekulából kivonunk egy hidrogénatomot, akkor radikális gyök keletkezik , egy molekula , egy kötetlen elektronnal , amelyet alkilcsoportként ismerünk. Ennek az alkilcsoportnak az elnevezését úgy kapjuk , hogy az -an -ot egy -il -csoportra cseréljük az alkán végén, amelyből a hidrogénatomot eltávolítottuk . Szimbolikusan az alkilcsoportokat gyakran R -vel jelölik; ha az alkilcsoportok eltérőek, ezt jelzi az R 1 , R 2 , R 3 , stb
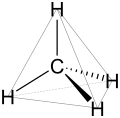
Molekuláris geometria
sp³ hibridizáció a metán .
Az alkánok térbeli szerkezete közvetlen hatással van fizikai és kémiai tulajdonságaikra. A szén elektronkonfigurációja kulcsfontosságú a megértésükhöz. Alapállapotban atomjainak négy szabad elektronja van, az úgynevezett vegyértékelektronok , amelyek kötésekhez és reakciókhoz állnak rendelkezésre. A kötetlen szénatomban ez a négy elektron különböző energiájú pályákon, alkánokban van, azonban a szénatom mindig sp3-hibridizált , ami azt jelenti, hogy a négy kiinduló pálya (egy s pálya és három p pálya ) egymásra helyezésével négy új ugyanolyan energiájú pályák állnak rendelkezésre. Ezek térben tetraéder alakban vannak elrendezve, a köztük lévő szög tehát 109,47 fok.
Kötéshosszak és kötési szögek
Egy alkánmolekula csak CH és CC kötéseket tartalmaz (egyszénes kötések). Az előbbi abból adódik, hogy egy sp3 hibrid szénpálya átfedésben van a hidrogén 1 -es pályájával, az utóbbi pedig két különböző szénatomból álló sp³ hibrid pálya átfedéséből.
A kötés hossza 109 pikométer a CH kötésnél és 154 pikométer a CC kötésnél, így a két szénatom közötti távolság körülbelül 50 százalékkal nagyobb, mint a szén és a hidrogénatom közötti távolság, ami elsősorban a különböző atomsugaraknak köszönhető .
A kötések térbeli elrendezése a négy sp³ pálya igazításából következik - mivel ezek tetraéderes módon vannak elrendezve, ezek egyben a CC és a CH kötések is, tehát rögzített, 109,47 fokos szög is van közöttük. A szerkezeti képlet , amely tökéletesen egyenes vonalban mutatja be a molekulák kötéseit, ebből a szempontból nem felel meg a valóságnak.
Az alkánok konformációja
A szerkezeti képlet és a kötési szög ismerete általában nem határozza meg teljesen a molekula térbeli szerkezetét. Minden szén-szén kötésnek van egy további szabadsági foka : az a szög, amelyet a két kötőatomhoz kötődő három atom vagy atomcsoport egymáshoz képest alakít. Az ezekkel a szögekkel leírt térbeli elrendezést a megfelelő molekula konformációjának nevezzük .
Etán
Az alkán osztályon belül a legegyszerűbb eset az etán; itt pontosan egy CC kötvény van. Ha a meghatározott tengely mentén nézi a molekulát, akkor az úgynevezett Newman -vetületet kapja : az egyik szénatom látható a vetületben a három hidrogénatommal az előtérben, a másikat szimbolikusan egy kör borítja, és definíció, a háttérben van; a három hidrogénatomhoz kapcsolódó kötések csak részben láthatók a diagramon. Mind az első, mind a hátsó három hidrogénatom 120 fokos szöget zár be egymással a vetületben, ahogyan azt a tetraéder síkba vetítésének is alkalmazni kell. Azonban, a szög θ a két csoport között a hidrogénatomok nem rögzített - leírja a konformációban etán molekulában.
A konformációs szög bármilyen értéket feltételezhet 0 és 360 fok között, de minőségileg csak két különböző konformáció érdekes:
- Az ekliptikus konformációban a konformációs szög 0, 120 vagy 240 fok, a vetületben egy elülső és egy hátsó hidrogénatom egybeesik.
- A lépcsős konformációban a konformációs szög 60, 180 vagy 300 fok, így a vetületben egy hátsó hidrogénatom két elülső között helyezkedik el.
A két konformáció, más néven rotamerek , energiájukban, amelyet ebben az esetben torziós energiának neveznek, körülbelül 12,6 kilojoule mólonként különböznek. Míg az ekliptikus konformáció ezt maximalizálja, és ezért instabil, a lépcsőzetes konformáció minimalizálja, ezért ez energetikailag előnyös. Az összes többi alakzat e két véglet között helyezkedik el energiájukat tekintve. A különbség okát még nem tisztázták teljesen: az ekliptikus konformációban az elülső és a hátsó szénatom CH kötéselektronjai közötti távolság kisebb, az elektrosztatikus taszítás közöttük és ezáltal az állapot energiája nagyobb. Ezzel szemben a lépcsőzetes konformáció lehetővé teszi a kötő elektronok nagyobb delokalizációját , ez egy kvantummechanikai jelenség, amely stabilizálja a szerkezetet és csökkenti az energiát. Ma az utóbbi magyarázatot tartják valószínűbbnek.
Az etánmolekula torziós energiája kicsi a szobahőmérsékletű hőenergiához képest, így azután állandó forgásban van a CC tengelye körül. Azonban rendszeres időközönként "bezárja" a lépcsőzetes konformációt, így az összes molekula körülbelül 99 százaléka közel van az energiaminimumhoz. Az átmenet a két szomszédos ingadozó konformációját mindössze átlagosan 10 -11 másodperc.
Magasabb alkánok
Míg minőségileg ugyanaz vonatkozik a propánmolekula két CC kötésére, mint az etánra, a bután és az összes magasabb alkán helyzete összetettebb.
Ha megnézzük a bután molekula átlagos CC kötését, akkor a két szénatom mindegyike két hidrogénatomhoz és egy metilcsoporthoz kötődik. Amint a Newman -vetületből látható, négy minőségileg eltérő rotamer különböztethető meg, amelyek között bármilyen átmeneti állapot lehetséges. Az etánhoz hasonlóan a maximális vagy minimális energia konformációinak felelnek meg:
- Ha a két metilcsoport ugyanazon a helyen van a vetületben, azaz 0 fokos torziós szögben, akkor a teljes ekliptikus vagy sziniplanáris konformációról beszélünk . Ez a torziós energia globális maximumának felel meg, mivel a metilcsoportok hidrogénatomjai olyan közel kerülnek, hogy az elektronfelhőik között taszítás lép fel.
- 60 vagy 300 fokos torziós szögnél a konformációt ferde vagy szinklinárisnak nevezik ; Az ekliptikus szerkezetekkel ellentétben itt az elülső szénatom összes atomja vagy atomcsoportja a vetületben a hátsó szénatom atomjai között helyezkedik el. Ez minimális energiát eredményez; A két metilcsoport egymáshoz való közelsége miatt azonban csak lokális, így továbbra is van energetikailag kedvezőbb konformáció.
- Ha a torziós szög 120 vagy 240 fok, a konformáció részben ekliptikus . Energetikailag kedvezőtlen ugyanazon okok miatt, mint az etán esetében. A teljesen elhomályosult konformációval ellentétben a két metilcsoport nem kerül túl közel, így az energia csak lokálisan jelenti a maximumot.
- Végül 180 fokos torziós szögben egy antiperiplanáris konformáció látható. Az etán lépcsőzetes konformációjához hasonlóan az elektronok fokozott delokalizációja figyelhető meg , amely csak kvantummechanikával magyarázható , ugyanakkor a két metilcsoport a lehető legnagyobb térbeli távolságot foglalja el egymástól. A torziós energia ezért globálisan minimálisra csökken ebben az állapotban.
A szin- és antiperiplanáris konformáció közötti energiarés körülbelül 19 kilojoule / mól, ezért még mindig kicsi a szobahőmérsékleten mért hőenergiához képest. Ezért a központi CC tengely körüli forgatások továbbra is könnyen lehetségesek. Az etánhoz hasonlóan azonban nem valószínű, hogy egy bizonyos állapotban lévő molekulát megtalálnak; az antiperiplanáris konformáció esetében körülbelül kétszer olyan magas, mint a szinklinális konformáció, míg a két ekliptikus konformációnál elhanyagolhatóan kicsi.
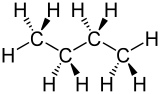
A magasabb alkánok esetében a kép alapvetően ugyanaz - minden CC kötés esetében az antiperiplanáris konformáció, amelyben a csatolt alkilcsoportok a lehető legnagyobb távolságot foglalják el, energetikailag a legkedvezőbb, és ezért a legvalószínűbb. Emiatt az alkánok szerkezetét rendszerint cikcakkos elrendezés képviseli; ez a fent bemutatott molekuláris modellek esetében is így van. A tényleges szerkezet mindig némileg eltér ettől az idealizált konformációtól szobahőmérsékleten - így az alkánmolekulák nem rögzített rúd alakúak, ahogy a modell sugallhatja.
Más szénhidrogén molekulák, mint például az alkének, ezen az alapszerkezeten alapulnak, de a kettős kötések miatt merevített szakaszokat is tartalmaznak , ami tartós "hajlításhoz" vezethet.
A magasabb alkánláncok alapvetően hosszúkás konformációjúak. 18 és 19 láncszem között hajtogatott hajtű szerkezetek is észlelhetők alacsony hőmérsékleten . Hajtű szerkezetek kialakításához a szénhidrogénláncokat először fel kell melegíteni, majd rendkívül gyorsan le kell hűteni mínusz 150 ° C -ra egy hordozógáz segítségével.
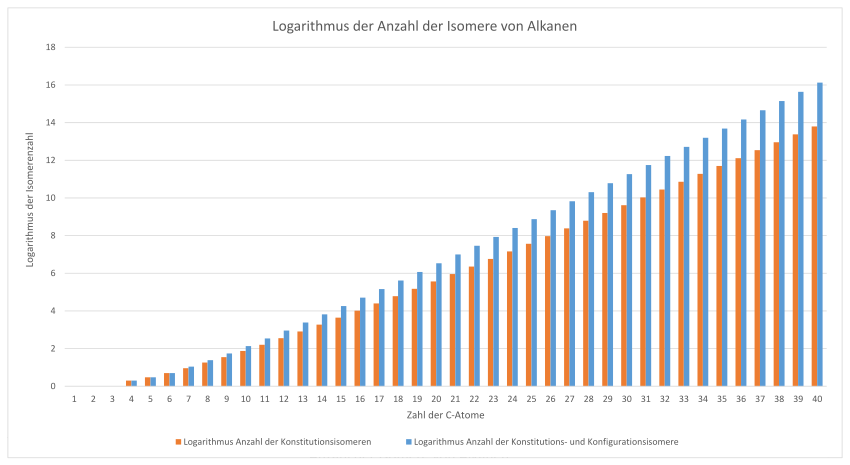
Az alkánok izomerjeinek száma
Nincs egyszerű képlet az alkánok izomerjeinek számának meghatározására; egy algoritmussal és egy fa struktúrával kell dolgozni.
| A szénatomok száma | Alkotmányos izomerek száma | Az alkotmány száma és
Konfigurációs izomerek |
|---|---|---|
| 1 | 1 | 1 |
| 2 | 1 | 1 |
| 3 | 1 | 1 |
| 4. | 2 | 2 |
| 5 | 3 | 3 |
| 6. | 5 | 5 |
| 7 | 9 | 11 |
| 8. | 18 -án | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 -én | 1858 | 6563 |
| 15 -én | 4347 | 18,127 |
| 16 | 10,359 | 5,0699 |
| 17 -én | 24 894 | 143,255 |
| 18 -án | 60 523 | 408,429 |
| 19 | 148,284 | 1 173 770 |
| 20 | 366,319 | 3 396 844 |
| 21 | 910,726 | 9,892,302 |
| 22 -én | 2 278 658 | 28,972,080 |
| 23 | 5,731,580 | 85,289.390 |
| 24 | 14,490,245 | 252,260,276 |
| 25 -én | 36 797 588 | 749,329,719 |
| 26 -án | 93.839.412 | 2 234 695 030 |
| 27 | 240,215,803 | 6 688 893 605 |
| 28 | 617.105.614 | 20 089 296 554 |
| 29 | 1 590 507 121 | 60,526,543,480 |
| 30 -án | 4,111,846,763 | 182.896.187.256 |
| 31 | 10 660 307 791 | 554,188,210,352 |
| 32 | 27 711 253 769 | 1 683 557 607 211 |
| 33 | 72,214.088.660 | 5,126,819,371,356 |
| 34 | 188.626.236.139 | 15.647.855.317.080 |
| 35 | 493,782,952,902 | 47,862,049,187,447 |
| 36 | 1,295,297,588,128 | 146.691.564.302.648 |
| 37 | 3 404 490 780 161 | 450,451,875,783,866 |
| 38 | 8 964 747 474 595 | 1 385 724 615 285 949 |
| 39 | 23 647 478 933 969 | |
| 40 | 62.481.801.147.341 |
Ezek a számok az elméletileg lehetséges izomerek. Sokuk azonban szterikus okok miatt nem életképes. Ez a lista a 100 szénatomos alkotmányos izomerek számát mutatja.
tulajdonságait
Az alkánok különösen egységes anyagosztályt alkotnak; néhány képviselő tulajdonságainak ismerete elegendő a többiek viselkedésének előrejelzéséhez. Ez vonatkozik az alkánok olvadás- és forráspontját befolyásoló intra- és intermolekuláris kölcsönhatásaira , valamint szintéziseikre és reakcióikra is .
Fizikai tulajdonságok
A molekuláris szerkezet, különösen a molekulák felületének mérete határozza meg a kapcsolódó anyag forráspontját: minél kisebb a felület, annál alacsonyabb a forráspont, mivel a molekulák között ható Van der Waals erők kisebbek; a felület csökkentése elágazással vagy gyűrű alakú szerkezettel érhető el. A gyakorlatban ez azt jelenti, hogy a magasabb széntartalmú alkánok általában magasabb forráspontúak, mint az alacsonyabb széntartalmú alkánok; az el nem ágazó alkánok forráspontja magasabb, mint az elágazó, a gyűrű alakúak pedig magasabb forráspontúak, mint az el nem ágazóak. Öt szénatomból az el nem ágazó alkánok normál körülmények között folyékonyak, tizenhétből szilárdak. A forráspont CH 2 csoportonként 20 és 30 ° C között nő .
Két kivételtől eltekintve az etán és a propán esetében az alkánok olvadáspontja is emelkedik a szénatomok számának növekedésével; azonban különösen a magasabb alkánok esetében az olvadáspont lassabban emelkedik, mint a forráspont. Ezenkívül a páratlan szénatomszámú alkánok és a páros szénatomszámú alkánok olvadáspontja jobban nő, mint fordítva. Ennek a jelenségnek az oka az egyenletes szénszámú alkánok nagyobb csomagolási sűrűsége. Az elágazó láncú alkánok olvadáspontja az elágazó szénláncú alkánok megfelelő értéke felett vagy alatt lehet. Minél terjedelmesebb a molekula, annál nehezebb a megfelelő anyagot szorosan becsomagolni, és annál alacsonyabb az olvadáspont. Ezzel szemben számos izoalkán van, amelyek sokkal tömörebb szerkezetűek, mint a megfelelő n -alkánok; ebben az esetben tehát olvadáspontjuk magasabb, mint egyenes vonalú izomereik.
Az alkánok sem vezetnek áramot, sem tartósan nem polarizálódnak . Emiatt nem képeznek hidrogénkötéseket, és nagyon nehezen oldódnak poláris oldószerekben, például vízben . Mivel a hidrogénkötések az egyes vízmolekulák között, egy alkán közvetlen közelében, távol állnak tőle, és ezért nem izotróp orientáltak, azaz nem mutatnak egyenletesen minden irányba, mindkét anyag keveréke a molekuláris rend növekedését eredményezné . Mivel ez a termodinamika második törvénye szerint tilos , a keverés során mindig két külön réteg keletkezik. Az alkánokat ezért víztaszítónak vagy hidrofóbnak nevezik . A poláros oldószerekben való oldhatóságuk viszont jó, ezt a körülményt lipofilnek nevezik . Például ugyanazon fizikai állapot mellett bármilyen arányban keverhetők egymással.
Néhány kivételtől eltekintve az alkánok sűrűsége nő a szénatomok számával. Mivel az összes folyékony alkánnál kevesebb, mint a víz, az alkánok mindig a tetején úsznak, ha megpróbáljuk összekeverni őket, ezért az égő, folyékony alkánokat nem lehet vízzel eloltani.
Kémiai tulajdonságok
Általánosságban elmondható, hogy az alkánok viszonylag alacsony reaktivitást mutatnak, mivel CH- és CC -kötéseik viszonylag stabilak, és nem könnyen törhetők fel. A legtöbb más szerves vegyülettel ellentétben nincsenek funkcionális csoportjaik sem .
Ők csak akkor reagálnak nagyon rosszul a ionos vagy általánosabban poláros anyagok. A p K s értéke felett van 60 (metán 48), így gyakorlatilag nem reagálnak egyáltalán normál savakkal vagy bázisokkal, amit az is jelez a közönséges neve paraffin (latin: parum affinis = enyhén ferde). Nyersolajban az alkánmolekulák még kémiailag változatlanok maradtak évmilliók óta.
Azonban az alkánok redoxreakciókba lépnek , különösen oxigénnel és halogénnel, mivel szénatomjaik nagymértékben redukált állapotban vannak; metán esetén még a lehető legalacsonyabb oxidációs állapotot is elérjük −IV. Az első esetben égési sérülésekről , a második esetben szubsztitúciós reakciókról van szó .
A gyököknek , azaz a párosítatlan elektronokkal rendelkező molekuláknak nagy szerepe van a legtöbb reakcióban, beleértve az úgynevezett krakkolást és reformálást is, amelyben a hosszú láncú alkánok rövid láncúakká és az el nem ágazó alkánok elágazóvá alakulnak.
Az erősen elágazó molekulák esetében eltérés tapasztalható az optimális kötési szögtől, amit az okoz, hogy a különböző szénatomokon elhelyezkedő alkilcsoportok egyébként térben túl közel kerülnének. Az így kapott „feszültség”, más néven sztérikus feszültség , sokkal reaktívabbá teszi ezeket a molekulákat.
Reakciók
Reagál oxigénnel
Minden alkán oxigénnel reagál, ezért gyúlékony, de nem elősegíti a tüzet ; lobbanáspontjuk azonban a szénatomok számának növekedésével emelkedik. Más szénhidrogénekhez, például alkénekhez és alkinekhez képest , ezek reagálnak, és felszabadítják az energia nagy részét. A kettős vagy hármas kötés több energiát szabadít fel, mint az egyetlen kötés, de ezt túlkompenzálja a molekula nagyobb számú oxidálható hidrogénatomja (6 az etán, 4 az etén és 2 az etin esetében). Az égés standard entalpiái megközelítőleg a következő értékek:
- Etán : Δ c H ° = -1560,7 kJ / mol
- Etén : Δ c H ° = −1411,2 kJ / mol
- Etil : Δ c H ° = −1301,1 kJ / mol
Ez azt jelenti, hogy az energia nagy része az etán elégetésekor szabadul fel (negatív entalpia). Ha elegendő oxigénellátás van, az alkánok gyengén világító, nem kormos lánggal égnek.
Kémiailag az oxigénnel való reakció egy redox reakció, amelyben az alkánok oxidálódnak és az oxigén redukálódik. Teljes égés esetén a szén reagál a szén -dioxidra (oxidációs szám + IV) és a hidrogén vízre, amely vízgőz formájában szabadul fel:
- Az n -alkán oxigénnel reagálva vizet és szén -dioxidot képez.
A teljes égési energia viszonylag rendszeresen növekszik a szénatomok számának növekedésével; minden CH 2 csoport körülbelül 650 kilojoule -t ad molonként. Az a tény, hogy az elágazó láncú alkánok égési energiája valamivel alacsonyabb, mint az el nem ágazó alkánoké, azt jelzi, hogy az előbbi csoport stabilabb.
Ha az alkánok nem égnek el teljesen, mert túl kevés oxigén áll rendelkezésre, nemkívánatos melléktermékek, például alkének, szén és szén-monoxid képződnek, és az energiahozam alacsonyabb; ezért fontos az alkánok teljes elégetése. Példa a hiányos égésre a következő reakció
- Az oktán oxigénnel reagálva szén -dioxidot, szén -monoxidot , szenet (koromot), propént és vizet képez .
A fekete füst tehát elégtelen oxigénellátást jelez a benzin elégetésekor.
Reakciók a halogénekkel
Az alkánok másik fontos reakciócsoportja a halogénezési reakciók - szintén a redoxreakciók nagyobb csoportjába tartoznak, mivel az érintett szénatomok oxidációs száma változik.
A halogénezés, a hidrogénatomok egy alkándikarbonsav részlegesen vagy teljesen helyettesítve vagy szubsztituálva halogénatomokkal, például fluor- , klór- vagy brómatom , ezért az egyik beszél egy szubsztitúciós reakció . A reakció során úgynevezett halogén - alkánok keletkeznek , általában keverékben, amint az a metánra vonatkozó következő példából is látható:
- A metán klórral reagálva mono-, di-, tri- és tetraklór- metánt , valamint hidrogén-kloridot képez .
Az egyes halogén -alkánok keverési aránya a reakció körülményeitől és a reakció lefolyásától függ, és a reakcióegyenletben teljesen önkényesen választják meg, azaz nem reprezentatívak.
A klórral való reakció még alacsony energiabevitellel is kiváltódik ultraibolya fény formájában - a reakció nagy energiaegységre jutó magas hozama azt jelzi, hogy láncreakcióról van szó . Ebben az esetben, ha egy halogéngyök jelen van, a reakció során folyamatosan újat állítanak elő, legalábbis a halogénatomok feleslegének lebontásáig. Tehát ez radikális helyettesítés .
Mint minden láncreakciónál, a halogénezési reakciónak is három lépése van:
- Kezdeményezés: A kétatomos halogénmolekulák homolitikusan, például nagy energiájú fénysugárzással, azaz az elektronok szimmetrikus eloszlásával gyökre oszlanak:
- Szaporítási 1. lépés: A halogéngyök hidrogénatomot szabadít fel egy alkánmolekulából, és egy alkilcsoportot hagy maga után:
- 2. szaporítási lépés: Egy alkilcsoport leválaszt egy halogénatomot a halogénmolekuláról, és halogéngyököt hagy maga után:
- Az 1. és a 2. lépés folyamatosan változik a reakció során - egyre több reakciótermék keletkezik néhány kezdeti klórgyökből.
- Termináció: A reakció leáll, amikor két gyök egymással való találkozásának valószínűsége nagyobb lesz, mint egy kiindulási termék (vagy egy még nem teljesen halogénezett alkán) találkozásának valószínűsége. Ebben az esetben a rekombináció következik be:
- Bár ezek közül a legutóbbi lezárási reakciók is haloalkánokhoz vezetnek, az így előállított termékek száma elhanyagolható a láncreakcióban előállítottak számához képest.
A fenti megfontolás során nem hangzott el nyilatkozat arról, hogy adott alkán esetén mely hidrogénatomok cserélődnek először. Ez a kérdés nem merül fel a metán vagy az etán legfontosabb eseteiben, mivel minden hidrogénatom egyenértékű. A propántól kezdve azonban néhány közülük másodlagos vagy harmadlagos szénatomokhoz kötődik, azaz azokhoz, amelyek két vagy három kötéssel kapcsolódnak más szénatomokhoz. Ezek a kötések gyengébbek, ami halogénezés esetén azt eredményezi, hogy a másodlagos vagy akár harmadlagos szénatomon elhelyezkedő hidrogénatomokat előnyösen halogének helyettesítik.
Példa: 2-klór-propán CH 3 -CHCI - CH 3 fordul elő gyakrabban, mint a reakció terméket, mint 1-klór-propán CH 2 Cl - CH 2 -CH 3 , mint ami statisztikailag várható.
A reakciósebesség rendkívül eltérő a négy halogén esetében. 27 ° C -on ez az arány
F: Cl: Br: I = 140 000: 1300: 9 · 10 −8 : 2 · 10 −19 .
Ebből már leolvasható a reakciók különböző lefolyása: Fluorral az alkánok alig szabályozható módon reagálnak, klórral mérsékelten, brómmal gyengén és csak fény hatására, jóddal viszont gyakorlatilag nem egyáltalán.
A jódozás még energetikailag is kedvezőtlen, ezért a jódot gyökfogóként használják a halogénezési reakciókban a láncreakciók leállítása érdekében. A szubsztitúciós reakció leállításával részben szabályozható, hogy növelje az adott reakciótermék hozamát.
A klórozott és fluortartalmú metángázok különleges műszaki jelentőséggel bírnak, de az ezekre adott reakció robbanáshoz vezethet. Triklór-metánnal korábban használt , mint egy érzéstelenítő néven kloroform , fluor--klór szénhidrogének szolgált hajtógázok sokáig, amíg elvesztették fontosságát miatt káros hatást gyakorol a Föld ózonréteg .
A haloalkánok kémiailag kimutathatók a Beilstein -teszt segítségével .
Repedés és reformálás
A repedés és a reformálás fontos reakció a kőolaj feldolgozásában .
Az előbbiekben a sokkal keresettebb alacsonyabb számú alkánokat magasabb alkánokból nyerik magas nyomáson és magas hőmérsékleten . C [BOND] A C kötések katalizátorokon , például alumínium -oxidon oszlanak meg . példa
- A Dodecane decil- és etilcsoporttá válik.
Ezek új alkánokat képeznek. Példa:
- Egy etil- és propilgyök reakcióba lépve pentánt képez.
Megfelelő reakciókörülmények alkalmazhatók annak biztosítására, hogy ezen reakciók eredményeként elsősorban rövid alkánmolekulák képződjenek. Ugyanígy megelőzhetők a zavaró mellékreakciók, mint például az alkének képződése . Általában hidrogént adnak hozzá a krakkolás során a szennyeződések, például a kén vagy a nitrogén eltávolítása érdekében - ezt hidrokrakkolásnak nevezik .
A benzinként használt alkánkeverékek esetében viszont reformálásra van szükség. Ebből a célból az elágazó szénláncú alkánok, amelyek e célra kedvezőtlen égési tulajdonságokkal rendelkeznek, katalizátorokon elágazó alkánokká és arénákká , azaz aromás szénhidrogénné alakulnak át .
További reakciók
Nikkel katalizátorok segítségével hidrogént nyerhetünk az alkánokból vízgőzzel történő reakcióban. Az alkánok további reakciói a szulfo -klórozás és a nitrálás , amely salétromsavval való reakció, de mindkettő különleges körülményeket igényel. Az erjesztés alkánsavakká alakítása technikailag sokkal fontosabb .
hajtott, vezetett
A metán gyújtóforrás nélkül egy-nyolc százalékos légtérfogat-frakcióból felrobbanhat , és erős üvegházhatású gáz , és az alacsonyabb széntartalmú alkánok és a levegő néhány más keveréke öngyulladást okoz egy bizonyos alkánfrakcióból. Miatt éghetőségi, alkánok veszélyt jelentenek; a széntartalom növekedésével azonban a lobbanáspont is növekszik. A propán, bután, pentán, hexán, heptán és oktán és néhány más alkán veszélyes anyag, de MAK -értéküket viszonylag magasra állítják, pentán esetén 3000 mg / m³, hexán esetében csak 180 mg / m³. A pentán, a hexán, a heptán és az oktán szintén veszélyes a környezetre, és a magasabb alkánokat általában csak irritálónak vagy egyáltalán nem veszélyes anyagnak minősítik .
ábrázolás
Az alacsony széntartalmú alkánok magukból az elemekből állíthatók elő; magasabb nyomású alkánokat kell előállítani nagy nyomás alatt , a Bergius -eljárás szerint . Néhány reakció saját nevet kapott .
Az alkánok ábrázolása többféleképpen történhet:
- keresztül katalitikus hidrogénezéssel a alkének , például szerinti
- Előállítás haloalkánokból hidrogén segítségével . Példa:
- A szén -tetraklorid hidrogénnel reagálva hidrogén -kloridot és metánt képez
- a Kolbe elektrolízissel ; ebben az esetben az alkán -karboxilátok gyökökké redukálódnak, amelyek szén -dioxid felszabadulásával alkil -gyökökké bomlanak, amelyek dimálódnak alkánokká.
- a Wurtz -szintézis révén, amelyben alkánok képződnek, halogenán -alkánokból és fémorganylokból fémhalogéneket képezve. Általános reakcióegyenlet:
- A haloalkánok reakcióba lépnek a fémorganylokkal, alkánokat és fémhalogéneket képezve.
- A Bergius -eljárással az alkánokat nagy nyomás alatt szénből és hidrogénből állítják elő.
- A Fischer-Tropsch eljárással szén-monoxidból és hidrogénből folyékony alkánokat állítanak elő . Példa:
- A szén -monoxid hidrogénnel reagálva metánt és vizet képez .
1985 -ben elkészítették az egyik leghosszabb szintetizált alkánt; pontosan 390 szénatomos lánchosszúságú molekulákból áll (C 390 H 782 ).
Esemény
Az alkánok a Földön és a Naprendszerben is előfordulnak , de csak az első 100 -ban, legtöbbjük csak nyomokban. Más égitesteknél nagy jelentőségűek elsősorban a könnyű szénhidrogének: A két metán- és etángáz kimutatható volt mind a Hyakutake üstökös farkában, mind egyes meteoritokban , az úgynevezett széntartalmú kondritokban . A Jupiter , a Szaturnusz , az Uránusz és a Neptunusz külső gázbolygók légkörének fontos részét képezik . Sokáig ezeknek és a hosszabb láncú alkánoknak az egész óceánját gyanították a Szaturnusz Titán holdján , de ma feltételezik, hogy legfeljebb kisebb, etánból készült tavak vannak. A Marson metánnyomokat fedeztek fel a légkörben, ami eddig a legerősebb bizonyíték az élőlényekre (talajbaktériumokra) az adott bolygón.
A földön a metán nyomokban fordul elő a légkörben, tartalma körülbelül 0,0001 százalék vagy 1 ppm („milliomodrész”), és elsősorban a bakteriális archaea termeli . Az óceánok tartalma elhanyagolható a vízben való oldhatóság hiánya miatt, de a metán nagy nyomás alatt és alacsony hőmérsékleten található az óceánok alján fagyott jégben, úgynevezett metánhidrát formájában . Bár a mai napig nem bányászható kereskedelmi forgalomban, az ismert metán -hidrátmezők fűtőértéke meghaladja az összes földgáz- és kőolajlelőhely energiatartalmát sokszorosan - a metánhidrátból nyert metán tehát a jövőbeni üzemanyagok jelöltje.
Azonban az alkánok legfontosabb kereskedelmi forrásai ma egyértelműen a földgáz és a kőolaj , amelyek az egyetlen szerves vegyületek , amelyek ásványi formában természetes módon fordulnak elő. A földgáz elsősorban metánt és etánt, valamint propánt és butánt tartalmaz, míg a nyersolaj folyékony alkánok és más szénhidrogének keverékéből áll. Mindkettő akkor keletkezett, amikor az elhullott tengeri állatokat oxigénhiányos üledékek borították, és sok millió év alatt magas hőmérsékleten és magas nyomáson természetes anyaggá alakultak át. A földgázt például a következő reakcióval állították elő:
- A dextróz magas nyomáson és hőmérsékleten reagál a metánra és a szén -dioxidra.
Ezután porózus kőzetekbe gyűjtöttek, amelyeket a tetején vízzáró rétegek zártak le. Ellentétben a metánnal, amely folyamatosan újraformálódik nagy léptékben, a magasabb alkánok jelentős mértékben nem fordulnak elő a természetben. Előfordulásuk ezért néhány évtized múlva kimerül.
Szilárd alkánok fordulnak elő, mint bepárlási maradékot ásványolaj, hogy alakult ki, ismert földviasz . A természetes szilárd alkánok egyik legnagyobb lelőhelye a karibi Trinidad sziget La La Brea ún. Aszfalt- tójában található .
Használat és további feldolgozás
Egyrészt az alkánok fontos nyersanyagok a vegyiparban , ahol például műanyaggá dolgozzák fel őket , másrészt a világgazdaság legfontosabb tüzelőanyagai .
A feldolgozás kiindulópontja mindig a földgáz és a kőolaj. Ez utóbbit az olajfinomítóban frakcionált desztillációval választják szét, majd sok más fontos termékké, például benzinné dolgozzák fel . Ez kihasználja azt a tényt, hogy a kőolaj különböző „frakciói” különböző forráspontúak, és így könnyen elválaszthatók egymástól. Ezzel szemben az egyes frakciók forráspontjai közel vannak egymáshoz.
Egy bizonyos alkán megfelelő alkalmazási területe meglehetősen jól elosztható a benne lévő szénatomok száma szerint, bár a következő elhatárolás idealizált, és nem szigorúan alkalmazható:
Az első négy alkánt főleg fűtésre és főzésre használják. A metán és az etán a földgáz fő alkotóelemei; rendszerint nyomás alatt tárolják gázállapotban. Szállításuk azonban folyékony állapotban olcsóbb, a gázt ekkor nagy nyomással kell összenyomni.
A propán és a bután ezzel szemben cseppfolyósíthatók, alacsony nyomásúak, ezért folyékony formában folynak, mielőtt üzemanyagként használnák őket - LPG -ként a belső égésű motorokban és a mezőgazdaságban traktorok vezetésekor. -Propánt alkalmazunk, például a propán gáz égők, bután öngyújtók - amikor kiszabadul, a kissé a nyomás alatti folyadék, amely 95 százalék n- bután és 5 százalék izo- bután, válik egy gázkeverék és finom cseppecskék és olyan könnyű meggyújtani. Ezenkívül a két alkánt hajtóanyagként használják permetező kannákban.
A pentán és oktán között rendkívül illékony folyadékok vannak, ezért tüzelőanyagként használhatók a hagyományos belső égésű motorokban, mivel az égéstérbe való belépéskor könnyen gáz halmazállapotúvá válnak, és nem képeznek ott cseppeket, ami rontaná az égés egyenletességét. Csak elágazó láncú alkánok kívánatosak üzemanyagban, mert nem hajlamosak előgyulladni, mint az el nem ágazó alkánok. Egyfajta benzin előgyújtásának mértéke az oktánszáma . Azt jelzi, hogy az anyag milyen mértékben hajlamos öngyulladásra. A két alkánok heptánt ( n- heptán) és izo- oktán (2,2,4-trimetil-pentán) önkényesen választottuk, mint hivatkozási szám az oktán értékek, amelyek mindegyike oktánszámú 0 (heptán, hajlamos arra, hogy előre meggyullad) és 100 -as oktánszám ( izo -oktán , alig hajlamos spontán meggyulladni). Az üzemanyag oktánszáma azt jelzi, hogy az izo- oktán és a heptán keverékében mennyi izo- oktán térfogatszázalék felel meg annak kopogtató tulajdonságainak. Az üzemanyagként betöltött funkciójuk mellett a középső alkánok jó oldószerek a nem poláris anyagok számára is.
A nonántól a körülbelül hexadekánig terjedő alkánok, a tizenhat szénatomos alkánok, nagyobb viszkozitású folyadékok , ezért viszkózusabbak, ezért a szénszám növekedésével egyre kevésbé alkalmasak közönséges benzinben való használatra. Ehelyett a dízel- és repülőgép -üzemanyag fő alkotóelemét képezik . Mivel a dízelmotor vagy a turbina működési módja alapvetően különbözik a benzinmotorétól, nagyobb viszkozitásuk itt nem számít. A magas láncú alkántartalom miatt azonban a dízelüzemanyag alacsony hőmérsékleten megszilárdulhat, és ez a probléma elsősorban a pólusok közelében található. Végül is a megadott alkánok a kőolaj részét képezik, és korábban kőolajlámpákban használták őket.
A hexadekántól felfelé irányuló alkánok a fűtőolaj és a kenőolaj legfontosabb alkotóelemei . Az utóbbi funkció, ők is jár, mint egy anti- korróziós szert , mint a hidrofób jellege azt jelenti, hogy nincs víz juthat a részek, amelyek a korrózió veszélye. Sok szilárd alkánt használnak paraffinviaszként , amelyekből például gyertyákat lehet készíteni . Nem szabad azonban összetéveszteni a valódi viaszjal , amely elsősorban észterekből áll.
Az aszfaltban 35 vagy több szénatomos lánchosszúságú alkánok találhatók , így többek között útburkolatként használják őket. Összességében azonban a magasabb szénatomszámú alkánoknak kevés jelentősége van, ezért többnyire repedés hatására bontják őket alacsonyabb alkánokra.
Alkánok az élő természetben
Az alkánok sokféleképpen előfordulnak a természetben, de nem biológiailag nélkülözhetetlen anyagok .
Alkánok baktériumokban és archeákban

Bizonyos típusú baktériumok átalakítják az alkánokat az anyagcserében . A páros szénláncokat részesítik előnyben, mert könnyebben lebomlanak, mint a páratlan.
Ezzel szemben néhány archaea , az úgynevezett metánképző , nagy mennyiségű szén-dioxidból állítja elő a legkönnyebb alkánt, a metánt. Az ehhez szükséges energiát molekuláris hidrogén oxidálásával nyerik:
- A szén -dioxid hidrogénnel reagálva metánt és vizet képez.
A metánképzők egyben a lápokban és mocsarakban felszabaduló mocsárgáz termelői is, amelyet hasonló módon termelnek a szennyvíztisztító telepek emésztőtornyaiban, és évente körülbelül kétmilliárd tonna metánt bocsátanak ki - ennek a gáznak a légköri tartalma szinte kizárólag ők állítják elő.
Többek között a cellulóz- emésztő növényevők metán kibocsátása . a kérődzők - különösen a szarvasmarha , amely naponta akár 150 litert is felszabadíthat - a termeszekbe végső soron a metángyártóknak köszönhető. Kisebb méretben, de az emberi bélben az összes legegyszerűbb alkánt is előállítják. A metánképző archeák ezért döntően részt vesznek a szénkörforgásban azáltal, hogy a fotoszintetikusan megkötött szenet visszajuttatják a légkörbe. A mai földgázkészletek valószínűleg nagyrészt ennek az élőlénycsoportnak köszönhetők.
Alkánok a gombákban és a növényekben
Az élőlények három fő eukarióta csoportjában, a gombákban , a növényekben és az állatokban az alkánok is játszanak bizonyos szerepet, bár összességében csekély. Előbbiben az illékonyabb képviselők főként a spórákban jelennek meg ; egyes speciális élesztők , az alkánélesztők is energia- és szénforrásként alkánokat használnak. A kerozin gomba ( Amorphotheca resinae ) elsősorban a légi üzemanyagot metabolizálja a hosszú láncú n -alkánokból.
A növények esetében az elágazó, gyűrűs, telítetlen és szerves anyagok mellett elsősorban a hosszú láncú szilárd képviselők találhatók; A többi csatlakozóval együtt szinte mindegyikben szilárd viaszréteget képeznek, amely lefedi a levegőben kitett külső bőrt, a kutikulát . Feladatuk egyrészt a kiszáradás elleni védelem, másrészt a fontos ásványi anyagok esőből való kimosásának megakadályozása, végül pedig a baktériumok, gombák és káros rovarok elhárítása - utóbbiak gyakran lábukkal süllyednek el a lágy, viaszos anyagba, és olyanná válik, amikor speciális igényekkel fut. A gyümölcsök, például az alma fényes rétege szintén hosszú láncú alkánokból áll. A szénláncok általában húsz és negyven atom közötti hosszúságúak, és a növények viaszszintézisében prekurzorként alkánsavakat tartalmaznak . Mivel az alkánsavak C 2 egységekből épülnek fel (citrátciklus), és az alkánok a karboxilcsoport elvesztésével keletkeznek - dekarboxilezés -, a magasabb szárazföldi növények levélviasz -alkánjai páratlan szénszám -preferenciával rendelkeznek a fent említett szénszámtartományban. A viaszréteg pontos összetétele nemcsak a fajtól függ, hanem az évszaktól függően változik, és olyan környezeti tényezőktől is függ, mint a fényviszonyok, a hőmérséklet vagy a páratartalom. Azt találták azonban, hogy különösen a füveket, a trópusi és szubtrópusi vegetációs övezetek legvilágosabb füveit ( sztyeppéken és szavannákon ) egyértelműen megkülönböztetik az alkánok lánchossz -eloszlási mintázataiban, és a fákhoz képest kissé eltolják a hosszabb szénláncokat. cserjék. Használja ezt a tényt z. B. Agronómusok a növényevők táplálkozási kutatásában , valamint klímakutatók, hogy felmérjék a föld éghajlatfüggő füves eloszlását a geológiai múltban.
Alkánok az állatokban
Az állatokban az alkánok olajos szövetekben fordulnak elő, de a telítetlen szénhidrogénekkel ellentétben ott nem játszanak jelentős szerepet. Ennek egyik példája a cápa máj, lehet beszerezni a olaj, amely a körülbelül 14 százaléka a prisztán van, egy alkán, amelynek a szerkezete neve 2,6,10,14-tetrametil pentadekán (C 19 H 40 ). Sokkal fontosabb, hogy előfordulnak feromonokban , kémiai hírvivő anyagokban, amelyekben különösen a rovarok támaszkodnak a kommunikációban. Bizonyos fajok, mint például a Longhorn bogár Xylotrechus colonus , amely elsősorban termel N- pentacosan (C 25 H 52 ), 3-methylpentacosan (C 26 H 54 ), és a 9-methylpentacosan (C 26 H 54 ), ezek keresztül továbbított testet kontaktus, így az egyik beszél a kontakt feromonokról. Más esetekben is , mint például a Tse-Tse fly Glossina morsitans morsitans , amelynek feromonja elsősorban a négy alkánból áll: 2-metilheptadekán (C 18 H 38 ), 17,21-dimetilheptatriakontán (C 39 H 80 ), 15,19-dimetilheptatriacontane (C 39 H 80 ) és 15,19,23 -trimetil -heptatriakontán (C 40 H 82 ), az anyagok testkontaktuson keresztül hatnak, és szexuális vonzóként szolgálnak - ezt a tényt használják a betegség leküzdésére.
Alkánok és ökológiai kapcsolatok
Egy példa, amelyben mind a növényi és állati használatra alkán szerepet játszanak az ökológiai közötti kölcsönös fajok andrena nigroaenea , amely tartozik a homok méhek ( andrena ), és a nagy pók parlagfű ( Pókbangó ), amely tartozik a orchideák (Orchidaceae ).. Az utóbbi a beporzás szempontjából az előbbitől függ. A homokméhek feromonokat is használnak partner keresésére; Az Andrena nigroaenea esetében a faj nőstényei olyan keveréket használnak, amely 3: 3: 1 arányban trikozánból (C 23 H 48 ), pentakozánból (C 25 H 52 ) és heptakozánból (C 27 H 56 ) áll. - hímekké válnak, akiket pontosan ez az illat vonz. Az orchidea kihasználja ezt a tényt - virágának egyes részei nemcsak homokméheknek néznek ki, hanem nagy mennyiségben bocsátanak ki a fent említett három anyagból - azonos arányban. Még a leveleket borító viasz kémiai összetétele is megegyezik a nőstény méhek nemi vonzójával. Ennek eredményeként számos hímet vonzanak a virágok, és úgynevezett álpopulációkat végeznek ott , és így megpróbálnak képzeletbeli partnerrel szaporodni a virágon. Bár ez a vállalkozás természetesen sikertelen a méhek számára, a párosítási kísérletek a pollent átviszik a megfelelő rovarra, amely a frusztrált elvonás után más virágokra is átvihető, azaz felhasználható az orchidea reprodukciójára. Az alkánok, amelyeket kémiai mimikriának neveznek, lehetővé teszik, hogy a pók ragwurz nagymértékben eltekintjen a hagyományos rovarcsalogató energia-igényes termelésétől.
irodalom
- Peter W. Atkins : Fizikai kémia rövid tankönyv. Wiley-VCH, Weinheim 2001, ISBN 3-527-30433-9 .
- Peter Pfeifer, Roland Reichelt (szerk.): H 2 O & Co Organic Chemistry. Oldenbourg, München 2003, ISBN 3-486-16032-X .
- KPC Vollhardt, Neil E. Schore: Szerves kémia. Wiley-VCH, Weinheim 2000, ISBN 3-527-29819-3 .
- Eberhard Breitmaier, Günther Jung: Szerves kémia. Thieme, Stuttgart 2001, ISBN 3-13-541504-X .
- F. Rommerskirchen, A. Plader, G. Eglinton, Y. Chikaraishi, J. Rullkötter: A hosszú láncú alkánok és az alkán-1-olok eloszlásának és stabil szénizotóp összetételének kemotaxonómiai jelentősége C 4 füves viaszokban. In: Organic Geochemistry , 37, 2006, 1303-1332, doi: 10.1016 / j.orggeochem.2005.12.013 .
web Linkek
- Enciklopédia: szerkezet, összefüggések, előfordulás, használat, tulajdonságok és szerkezet, repedés
- Tulajdonságok, előfordulás, nómenklatúra és izomerek
- Diákoknak megfelelő magyarázatok
Egyéni bizonyíték
- ↑ Belépés az alkánokra . In: IUPAC Compendium of Chemical Terminology („Aranykönyv”) . doi : 10.1351 / goldbook.A00222 .
- ↑ Der Brockhaus, Tudomány és technológia , Mannheim; Spektrum Akadémiai Kiadó, Heidelberg 2003.
- ^ Uwe Meierhenrich : Aminosavak és az élet aszimmetriája , Springer-Verlag, Heidelberg / Berlin 2008, ISBN 978-3-540-76885-2 .
- ^ Nils OB Lüttschwager, Tobias N. Wassermann, Ricardo A. Mata, Martin A. Suhm: Az utolsó alkán kiterjesztett alapállapot -konformációval . In: Angewandte Chemie . szalag 124 , nem. 39. , 2012. o. 482-485 , doi : 10.1002 / anie.201202894 .
- ^ Az alkánok strukturális izomerjei , a Bayreuthi Egyetem forgatókönyve , hozzáférés 2017. július 21 -én.
- ^ Siegfried Hauptmann, Jürgen Graefe, Horst Remane: Szerves kémia tankönyve . VEB Német kiadó az alapipar számára, Lipcse 1976. DNB 770047483
- ↑ Az alkánok sztereoizomerjeinek listája ( OEIS A000628 lista ) Letöltve: 2017. július 23.
- ↑ Alkotmányos izomerek száma 100 szénatomig. Hozzáférés: 2017. július 22.
- ^ Arnold Arni: Grundkurs Chemie I és II , Wiley-VCH, 2011, ISBN 978-3-527-33068-3 , 18-19.
- ↑ David R. Lide (szerk.): CRC Handbook of Chemistry and Physics . 90. kiadás. (Internetes verzió: 2010), CRC Press / Taylor és Francis, Boca Raton, FL, Heat of Combustion, 5-70.
- ↑ Bejegyzés a CAS -számhoz 109-66-0 a GESTIS anyag adatbázisa az IFA , elérhető június 29-én, 2015-ig. (JavaScript szükséges)
- ↑ Bejegyzés a CAS -számhoz 110-54-3 a GESTIS anyag adatbázisa az IFA , elérhető június 29-én, 2015-ig. (JavaScript szükséges)
- ↑ DA Carlson, PA Langley, P. Huyton: A tsetse fly szexferomonjai: a kontakt afrodiziákumok izolálása, azonosítása és szintézise. In: Science 201, 1978. 750-753. doi: 10.1126 / science.675256 .
- ^ M. Ayasse, W. Francke, BS Hansson, F. Ibarra, C. Löfstedt, HF Paulus, FP Schiestl: Orchidea beporzása szexuális csalással. In: Nature 399, 1999. 421. o .; doi: 10.1038 / 20829 .