Észter
| Észter |
|---|
 Karbonsav- észter |
 Mono -észter A foszforsav |
 Mono -észter A kénsavat |
 Salétromsav- észter |
 Észterek a salétromossav |
 Bórsav- triészter |
A kémia területén az észterek olyan kémiai vegyületek csoportját alkotják , amelyek formálisan vagy de facto képződnek egy sav és egy alkohol vagy fenol reakciójával a víz eltávolításával ( kondenzációs reakció ). Vannak szerves savak észterei (például karbonsavak , például ecetsav , szulfonsavak ) és szervetlen savak (például foszforsav , kénsav , bórsav , szénsav ).
Az észter kifejezést Leopold Gmelin kémikus alkotta 1850-ben az „ecetéter” kifejezésből, amely az etil-acetát történelmi neve . Az etil-acetát gőzének érzéstelenítő hatása van, hasonlóan az "éterhez" ( dietil-éter ), ezért az "ecetsav-éter" kifejezés.
Az észterek előállítása észterezés vagy észterképzés néven ismert .
Karbonsav-észter
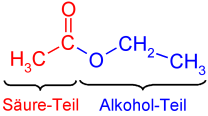
Karbonsav-észterek az karbonsavak a funkciós csoport -COOR. Egy savas és egy alkoholos részből állnak .
A karbonsav-észterek olyan anyagok csoportját alkotják, amelyekkel a szerves kémia és a természet gyakran találkozik ( gyümölcsészterek , zsírok , olajok).
Biológiailag fontos észterek a trigliceridek (más néven "glicerin-triészterek", ritkábban elavultak "semleges zsírok"). Ezek a természetes olajok (folyékony halmazállapotú állapot) vagy zsírok (szilárd) szinte mindegyike rosszul oldódik vízben, bár polárosak, mivel (néhány kivételtől eltekintve) három hidrofób alkilcsoportot tartalmaznak . Minél hosszabbak az alkilcsoportok, annál rosszabb a triészter oldhatósága vízben.
Foszforsav-észter
A foszforsav-észterek az ortofoszforsav - észterek, amelyek formailag vagy ténylegesen a savnak egy alkohollal és a víz eltávolításával történő reakciójából származnak. A nukleinsavak (szerkezetük részeként) a foszforsav észterei a cukrok alkoholfunkciójával (például ribóz vagy dezoxiribóz ). Szerkezetét tekintve megkülönböztetik a monoésztert, a diésztert és az orto-foszforsav triészterét. A foszforsav észterei és származékai közül a vegyületekről ismert, hogy hatásos rovarölő szerek (például E605 ). A származékok olyan erősen mérgező vegyületeket is tartalmaznak, mint a sarin , tabun és soman kémiai háborús szerek .
Kénsav-észter
A kénsav- észterekvagy az alkil-szulfátok a kénsav észterei . Széles körben vannak képviselve a természetben. (Példák: karragén , heparin vagy az úgynevezett szulfatidok, mint az agyi anyag komponensei). A hosszú szénláncú monoalkil-kénsav-észterek sóit, amelyeket gyakran zsíros alkohol-szulfátoknak neveznek,a kozmetikai termékekben anionos felületaktív anyagként használják (például: nátrium-lauril-szulfát ).
A dimetil-szulfát és a dietil-szulfát a kénsav dialkil-észterei, és a kémia területén erőteljes reagensként használják a metil- vagy etilcsoportok más molekulákba történő átvitelére. A kénsav dialkil-észterei alkilező hatása miatt mérgezőek és rákkeltők .
Salétromsav-észter
A salétromsav- észterek a salétromsav észterei. A benne lévő nitrocsoport (NO 2 ) mezomer stabilizált .
Speciális észterek
Vannak olyan savak észterei, amelyek szabad savaként instabilak és csak származékként létezhetnek (például ortokarbonsav-észterek vagy karbaminsav-észterek ). Másrészt az is előfordul, hogy egy észter alkoholkomponense nem létezik szabad vegyületként, mert ez átrendeződik, és csak az észtervegyület savval (például vinil-acetáttal ) stabilizálja .
Példák néhány más sav észterére
- Szulfonsav-észterek, az úgynevezett szulfonátok
- Nitroglicerin ( robbanó és gyógyhatású anyag , kémiailag helyes név a glicerin-trinitrát)
- A salétromsav- észtereket a Chrétien-Longi reakcióval állíthatjuk elő .
- Bórsav-trimetil-észter (a bór detektálása zöld lángszínnel)
- Kovasav-észter
- Szénsav-dietil-észter
- Tejsav-észter
- Triphosgene (a foszgén szintonja)
- Króm-sav-észter
Használat és előfordulás
Az alábbiakban csak példamutató példákat mutatunk be, mivel az észtercsoport nagyszámú molekulában fordul elő.
- A zsírok és zsíros olajok ( glicerin és zsírsavak észterei , például trigliceridek ) fontos élelmiszer-összetevők és energiatároló anyagok a legtöbb állati organizmus számára.
- A monogliceridek (ekvimoláris mennyiségű glicerin és zsírsav észterei) emulgeálószerek az élelmiszertermelésben,
- A biodízel egy metil-észter a zsírsavak .
- A méhviasz főleg miricil-alkohol (C 30 H 61 OH) észtereiből áll , pl. B. Myricyl palmitát (C 15 H 31 -COO-C 30 H 61 ).
- Számos észtert használnak ízesítőként , ezért egyeseket gyümölcsésztereknek is neveznek . Ilyen az illata. B. ecetsav-2-butil-észter [CH 3 –COO - CH (CH 3 ) C 2 H 5 ] alma, etánsav 2-metil-1-propil-észter szerint [CH 3 –COO - CH 2 CH (CH 3) ) 2 ] (Köznapi név izobutil-acetát ) szerint a banán, 2-hexil- -etanoát [CH 3 - COO - CH (CH 3 ) (C 4 H 9 )] szerinti eper.
- A cellulóz- észter- cellulóz- nitrátot füst nélküli hajtógázpor ( puskapor ) és műanyag celluloid előállítására használják, amelyet ma is használnak asztali teniszlabdák gyártásához.
- A poliésztert műanyagként használják, mint például PET-t ( P oly E Thylen T erephthalat), amelyet élelmiszer-csomagolások előállítására használnak, és italpalackokat, amelyek szintén alkalmazhatók a textíliákban.
- Az észtereket a lágyítókban is használják . Példák erre lenne észterei alkil szulfonsav mesamoll , és a ftálsav-észter dietil-hexil-ftalát ( DEHP ) lágyítószerként történő PVC .
- A gyógyszeres anyagokat gyakran észterezik , hogy lipofilebbek legyenek, és így könnyebben áthaladhatnak olyan gátakon, mint a vér-agy gát . Az e prodrug eredményeként létrejövő anyagcserével az aktív forma akkor. Az egyik példa a heroin , amely kettős acetilezéssel jobban eljut a központi idegrendszerbe és így az opioid receptorokba , mint az aktív morfin forma . Savas gyógyszerek, mint pl B. Az ACE-gátlókat gyakran észterezik. Szintén szalicilsav az acetilszalicilsav észterezett (fájdalom, gyulladás és láz kezelésére), hogy a gyomorba kerüljön az anyag. Az amil-nitrit ((CH 3 ) 2 CH - CH 2 –CH 2 – O - N = O) vagy a glicerin-trinitrát , hasonlóan más alkil-nitritekhez és nitrátokhoz, nitrogén-oxid felszabadításával lazítóan hat a simaizom-izmokra , és néha használják a kezelés a mai napig Angina támadások vagy használt intenzív ellátás gyógyszer csökkenti a vérnyomást .
- Az észtereket rovarölő és vegyi fegyverekként használják , pl. B. foszforsav-észterek . Az előbbi közé tartozik a paration és a diklórfosz , míg az utóbbiak közé tartozik a szarin (metil-fluor-foszfonsav-izopropil-észter), a soman (metil-fluor-foszfonsav-1,2,2-trimetil-propil-észter) és a tabun (dimetil- foszforamidocianidsav -etil-észter).
- Kénsav-észterek, pontosabban zsíros alkohol-szulfátok , mint pl. B. nátrium-lauril-szulfátot használnak felületaktív anyagként a kozmetikumokban.
- Glicerin-trinitrát (szintén nitroglicerint, O 2 NO-CH 2 -CH (ONO 2 ) -CH 2 -ONO 2 ) használják, mint egy robbanásveszélyes , és, mint gyógyszer.
- A forbol-észterek a tejfű növények levében találhatók, és a súlyos bőrégések és a gasztroenteritis mellett rosszindulatú daganatokat is kiválthatnak. A karcinogén , vagyis a rák elősegítő hatását úgy tűnik, hogy jöjjön mintegy stimulálása révén a protein kináz C , amely módosítja a növekedési viselkedését a rákos sejtek.
Karbonsav-észter - Gyümölcsökben (szelekcióban) előfordul, mint olyan komponens, amely szagot és ízt ad
web Linkek
Egyéni bizonyíték
- ↑ Wolfgang Legrum: Illatanyagok a bűz és az illat között , Vieweg + Teubner Verlag (2011) 85–86., ISBN 978-3-8348-1245-2 .
- ^ MD Lechner, K. Gehrke és EH Nordmeier: Makromolekulare Chemie . 4. kiadás. Birkhäuser, Bázel / Boston / Berlin 2010, ISBN 978-3-7643-8890-4 , 126-130.
- ^ Fritz Röthemeyer, Franz Sommer: Kautschuktechnologie . 2. kiadás. Hanser, München / Bécs 2006, ISBN 978-3-446-40480-9 , 335–337.













