toluol
| Szerkezeti képlet | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Tábornok | |||||||||||||||||||
| Vezetéknév | toluol | ||||||||||||||||||
| más nevek |
|
||||||||||||||||||
| Molekuláris képlet | C 7 H 8 | ||||||||||||||||||
| Rövid leírás |
színtelen, jellegzetes szagú folyadék |
||||||||||||||||||
| Külső azonosítók / adatbázisok | |||||||||||||||||||
| |||||||||||||||||||
| tulajdonságait | |||||||||||||||||||
| Moláris tömeg | 92,14 g mol -1 | ||||||||||||||||||
| Fizikai állapot |
folyadék |
||||||||||||||||||
| sűrűség |
0,87 g cm -3 (20 ° C) |
||||||||||||||||||
| Olvadáspont |
-95 ° C |
||||||||||||||||||
| forráspont |
111 ° C |
||||||||||||||||||
| Gőznyomás |
|
||||||||||||||||||
| oldhatóság |
vízben szegény (520 mg l −1 20 ° C -on) |
||||||||||||||||||
| Dipólmomentum | |||||||||||||||||||
| Törésmutató |
1,4969 |
||||||||||||||||||
| biztonsági utasítások | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG / Svájc: 50 ml m −3 vagy 190 mg m −3 |
||||||||||||||||||
| Toxikológiai adatok | |||||||||||||||||||
| Amennyire lehetséges és szokásos, SI egységeket használnak. Eltérő rendelkezés hiányában a megadott adatok a szabványos feltételekre vonatkoznak . Törésmutató: Na-D vonal , 20 ° C | |||||||||||||||||||
A toluol , általános neve az IUPAC szerint, szintén a toluol , metil-benzol , fenil- metán , az IUPAC-nómenklatúra szerint metil-benzolnak nevezik, színtelen, jellegzetes szagú, illékony folyadék , amely sok tulajdonságában hasonlít a benzolra . A toluol egy aromás szénhidrogén ; gyakran helyettesíti a toxikus benzol mint oldószerben . Többek között benzin is tartalmazza .
etimológia
Mivel Henri Etienne Sainte-Claire Deville toluolt Tolú nyert, ő elfogadta a nevét Benzoën erre test, emlékeztet a balzsamok, amelynek ő jön a szinte általános jellegű, azaz, hogy a sav, a benzoesav. Berzelius ekkor javasolta a Toluin nevet éves jelentéseiben . A toluolban levő módosítás először jelenik meg Muspratt és Hoffmann művében , akik azonban - valószínűleg tévesen - utalnak Berzelius fenti szakaszára a név tekintetében.
sztori
A toluolt először Pierre-Joseph Pelletier és Filip Neriusz Walter izolálta 1837-ben. Pelletier megtalálta a vegyületet a gázban, amelyet a tengeri fenyő (akkor Pinus maritima ) kérge bocsát ki . Pelletier nevű anyag retinaphta után fenyő gyanta . 1841-ben ezután Henri Etienne Sainte-Claire Deville- től toluolt nyertek a toluolos balzsamból száraz desztillációval ; A jelenlegi név erre épül. A nitráló toluolt használva nitrálósav (keveréke salétromsav és kénsav ), a vegyész Julius WILBRAND termelt TNT először 1863-ban . A TNT nagyüzemi gyártása végül 1901-ben kezdődött Németországban; ezt az eljárást ma is alkalmazzák.
Előfordulás és kibocsátás
A toluol kis mennyiségben fordul elő a kőolajban és a kőszénkátrány lepárlásakor keletkező könnyűolajban . Mivel a benzin toluolt tartalmaz, többek között a gépjárművekben is felszabadul. Kis mennyiségben termelődik szerves anyagok hiányos égése során, például dohányzáskor. Az elmúlt években csökkent a toluol kibocsátása. Például Rajna-vidék-Pfalzban az éves átlag 30 µg / m 3 ; helytől függően azonban nagyobb ingadozások lehetnek ebben az értékben. A fő kibocsátási tényező a gépjárműforgalom, körülbelül 65% -kal, 33% -ban a toluoltermékek használatából és 2% -ban a toluoltermelésből származik. A felszabadult toluol a föld légkörében, mint a benzol, több nap múlva bomlik le hidroxilgyökökkel (OH gyökök) végzett reakciók során .
Kitermelés és bemutatás
A kőolajból való közvetlen kitermelés vagy a kőszén száraz lepárlása - a 2006 -os kőolajárak alapján - még nem gazdaságos.
Az iparban elsősorban a kőolaj feldolgozásakor nyerik az ( előállított krakkolással ) n -heptánt metil -ciklohexánná reformálva , majd dehidrogénezve toluollá. Ezt a folyamatot dehidrociklizációnak is nevezik .
A második világháború alatt a nyersolaj hiánya miatt szűk keresztmetszetek voltak a toluol előállításában Németországban, ezért is készült benzolból és metanolból Friedel-Crafts alkilezéssel . A Friedel-Crafts alkilezésnek korlátozó tényezői vannak, amelyek jelentősen csökkentik a hozamot és ezáltal gazdasági jelentőségét: az alkil-benzolok reaktívabbak, mint maga a benzol az elektrofil szubsztitúción aromás vegyületeken; ezért a nemrégiben képződött alkil -benzol hajlamos arra, hogy két vagy több alkilezett terméket képezzen. A toluol hozama alacsonyabb:
A kiindulási anyagok alacsony költségei miatt hatalmas mennyiségű anyagot folyamatosan átalakítanak, a keletkező toluolt folyamatosan elválasztják, és így kivonják az egyensúlyi reakcióból . A toluolt melléktermékként is előállítják az etén és a propén előállítása során . Ez az elérhető fotokémiai által izomerizációja a ciklohpetatrién .
A toluol termelése világszerte öt és tíz millió tonna között van.
tulajdonságait
Fizikai tulajdonságok
A toluol az alkil -benzolok legegyszerűbb képviselője . A levegőben csak hiányosan ég sárga, erősen kormos lánggal. A folyadék illata jellemző, csípős kellemesen (hasonló a benzol ), és egy szagküszöbértéket a 0,6-263 mg / m 3 . Toluol olvadékok át -95 ° C-on, forr át 111 ° C-on és normál körülmények között egy színtelen, tiszta, víz-fehér folyadék, amely nagyon fénytörési ( törésmutató : 1,4969). A víz , szinte oldhatatlan (0,47 g / l); Meg lehet keverni bármilyen arányban a szén-diszulfid , etanol és dietil-éter . Toluol is könnyen oldódik a kloroformban , acetonban és a legtöbb egyéb szerves oldószerek. A vegyület azeotróp elegyet képez számos oldószerrel . Az azeotróp készítményeket és forráspontokat az alábbi táblázat tartalmazza. N- hexán , n- heptán , n- oktán , benzol, etil-benzol , ciklohexanol , kloroform, szén-tetraklorid , aceton, metil-etil-keton , dietil-éter, etil-acetát , dimetil-formamid , dimetil-szulfoxid , szén-diszulfid és fenol nem képez azeotropokat .
| Azeotrópok különböző oldószerekkel | ||||||||||||
| oldószer | víz | Metanol | Etanol | 1-propanol | 2-propanol | 1-butanol | izo- butanol | sec -butanol | ||||
| Toluol tartalom | ban ben% | 80 | 31 | 32 | 51 | 31 | 68 | 55 | 45 | |||
| forráspont | ° C -ban | 85 | 64 | 77 | 93 | 81 | 106 | 101 | 95 | |||
| oldószer | Etándiol | Metil -glikol | Etil -glikol | 1,4-dioxán | Acetonitril | ecetsav | Piridin | Metil -izobutil -keton | ||||
| Toluol tartalom | ban ben% | 93 | 74 | 89 | 20 | 24 | 72 | 68 | 97 | |||
| forráspont | ° C -ban | 110 | 106 | 110 | 102 | 81 | 101 | 108 | 111 | |||
A dinamikus viszkozitás 0,6 mPa · s, így a toluol vékonyabb, mint a víz. A fűtőérték 40 940 kJ / kg.
| jellegzetes | típus | Érték [egység] | Megjegyzések |
|---|---|---|---|
| A képződés standard entalpiája | Δ f H 0 folyadék Δ f H 0 gáz |
12,0 kJ mol −1 50,1 kJ mol −1 |
folyadékként, mint gáz |
| Az égés entalpiája | Δ c H 0 gáz | −3910,9 kJ mol −1 | |
| Hőkapacitás | c o | 157,09 J mol −1 K −1 (25 ° C) 1,70 J g −1 K −1 (25 ° C) 137,2 J mol −1 K −1 (120 ° C) 1,49 J g −1 K −1 (120 ° C) |
folyadékként, mint gáz |
| Kritikus hőmérséklet | T c | 591,75 K | |
| Kritikus nyomás | p c | 41,58 bar | |
| Kritikus kötet | V c | 0,316 l mol −1 | |
| Kritikus sűrűség | ρ c | 3,17 mol·l −1 | |
| Acentrikus tényező | ω c | 0,264 | |
| A fúzió entalpiája | Δ f H | 6,61 kJ mol −1 | olvadáspontján |
| Párolgási entalpia | Δ V H 0 Δ V H |
38,1 kJ mol −1 33,18 kJ mol −1 |
normál nyomású forrásponton |
Kémiai tulajdonságok
A toluol normál körülmények között stabil és viszonylag inert. Hasonlóan reagál a fenolra és a benzolra . A toluol sok műanyagot megtámad, ezért általában üveg- vagy fémtartályokban tárolják. Az oxidációt (például savas kálium-permanganát -oldattal) a toluol benzil-alkoholhoz , és benzaldehid , hogy benzoesav alakítjuk. A toluol főleg gyökös szubsztitúciós reakciókba és elektrofil szubsztitúciós reakciókba lép . A nukleofil szubsztitúciós reakciók kevésbé gyakoriak.
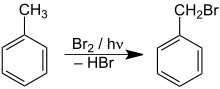
Különösen hő hatására vagy fény hatására a toluol gyökös szubsztitúciós reakcióba léphet a metilcsoporton megfelelő reagensekkel (pl. Bróm ) (lásd az SSS szabályt ):
Mivel a toluol viszonylag inert, az elektrofil szubsztitúciós reakciók viszonylag lassan mennek végbe rajta. Megfelelő katalizátor jelenlétében a reakciósebesség jelentősen megnövelhető (lásd KKK szabály ). Vannak előnyösen kialakított para- és orto -helyettesített termékek:

A toluol salétromsavval reagálva 4-nitrotoluolt és vizet képez , és képződik az izomer 2-nitrotoluol is. A tényleges nitrálószer (NO 2 + ) salétromsavból képződik kénsav jelenlétében:
A TNT (trinitrotoluol) többszörös nitrálással nyerhető.
Egy másik fontos reakció a toluol benzoesavvá oxidálása.
Biztonsággal kapcsolatos paraméterek
A toluol nagyon gyúlékony gőz-levegő keveréket képez. A vegyület lobbanáspontja 6 ° C. A robbanási tartomány 1,1 térfogat% (42 g / m 3 ), mint alsó robbanási határ (LEL) és 7,8 térfogatszázalék (300 g / m 3 ), mint felső robbanási határ (UEL). A korreláció a robbanási határokon a gőznyomás funkciót eredményez alsó robbanási pontja 3 ° C-on és egy felső robbanási pontja 40 ° C-on A határ oxigénkoncentráció körülbelül 9,6 térfogat% (100 ° C -on). A határrés szélességét 1,06 mm -nek határoztuk meg. Ennek eredményeként a IIA robbanási csoportba sorolható. A gyújtási hőmérséklet 535 ° C. Az anyag ezért a T1 hőmérsékleti osztályba tartozik . A 8 · 10–14 S · m −1 elektromos vezetőképessége nagyon alacsony, ezért kezelés közben elektrosztatikus töltések keletkezhetnek.
használat
A TNT -termelés mellett többek között toluolt használnak oldószerként. festékekhez, nyomdafestékekhez , lakkokhoz és ragasztókhoz használják. A kémiai szintézis alapvegyülete.
Ismert, hogy állandó jelölőkben is használják , amelyeket azonban ma már többnyire toluol és xilol mentesen állítanak elő .
A mérési tartománytól függően a toluolt töltőfolyadékként is használják a hőmérőkben .
toxikológia
A toluol nagyon gyúlékony és egészségre ártalmas. A toluol ideg-, vese- és esetleg májkárosodást okoz. Úgy gondolják, hogy a toluol káros a születendő gyermekre. A toluolgőzök belégzése nem specifikus tünetekhez vezethet, például fáradtsághoz, rossz közérzethez, érzékszervi zavarokhoz, mozgáskoordinációs zavarokhoz és eszméletvesztéshez. A rendszeres érintkezés toluolfüggőséghez vezethet, amelyet izgalom és izgalom kísér. A toluolgőzök narkotikus hatásúak, és rosszul irritálják a szemet és a légzőszerveket, allergiás reakciók lehetségesek a toluollal szemben. Úgy gondolják, hogy a toluol emberben ototoxikus . A toluolt jól szellőző helyen kell tárolni.
A toluol önmagában nem mutagén , de gyakran benzollal szennyezett. A toluol alacsonyabb toxicitása a benzolhoz képest a különböző anyagcserével magyarázható. A benzollal ellentétben a toluol alig metabolizálódik benzoesavvá a gyűrű oxidációjával, de főleg az oldallánc oxidációjával. Ennek oka a P 450 mono -oxigenáz -rendszer nagy szelektivitása a toluol metilcsoportja tekintetében. Emiatt alig keletkezik rákkeltő epoxid, mint a benzol esetében. A kis mennyiségű epoxid glutationhoz való konjugációval, a fenolba történő spontán intramolekuláris átrendeződéssel vagy diolra történő enzimatikus hidrolízissel bontható le.
A toluol és kis mennyiségű o-krezol a vizelettel ürül benzoesav és hippursav formájában .
Kockázatértékelés
A toluol kis mennyiségben is veszélyes a vízre (WGK 2). Könnyen biológiailag lebontható.
A toluol az EU -ban nem lehet anyag vagy részarány 0,1 tömegszázaléktól 2007. június 15 -e óta használt készítmények vagy keverékek ragasztókban és szórófestékekben, illetve forgalomba hozhatók . 2012 -ben az anyagértékelés részeként a toluolt az 1907/2006/EK rendelettel (REACH) összhangban felvették az EU folyamatban lévő cselekvési tervébe ( CoRAP ). Az anyag emberi egészségre és környezetre gyakorolt hatását újraértékelik, és szükség esetén nyomon követési intézkedéseket kezdeményeznek. A toluol lenyelésének hátterében a CMR- anyagként való besorolása, a fogyasztói felhasználás , a nagy (összesített) űrtartalom, az egyéb veszélyekkel kapcsolatos aggodalmak és a széles körű használat áll. Az újraértékelésre 2012-től került sor, és Finnország végezte el. Ezt követően közzétették a zárójelentést.
irodalom
- LAI hatáskérdések albizottsága: a toluol- és xilol -emissziók értékelése. Erich Schmidt Verlag, Berlin 1997, ISBN 3-503-04071-4 .
- Jürgen Angerer: A benzol, toluol, xilolok és etil -benzol által okozott munkahelyi egészségkárosodás megelőzése. Gentner, Stuttgart 1983, ISBN 3-87247-311-5 .
- A. Seeber, M. Blaszkewicz, P. Demes: Toluol a mélynyomásban. Záró jelentés egy kutatási projektről. HVBG, Sankt Augustin 2002, ISBN 3-88383-623-0 .
- Helmut Greim : Az egészségre ártalmas anyagok . A MAK értékek toxikológiai és foglalkozás -egészségügyi indoklása. Toluol. VCH, Weinheim 1985, ISSN 0930-1984 .
- Metil -benzol, toluol. In: Beilstein szerves kémia kézikönyve. 5. kötet (466. sz. Rendszer), H 280, EII 209. o .
web Linkek
- Felhasználás és veszélyek: André Sepeur: Toluol. In: Umweltlexikon-online.de. 2012. február 22., hozzáférés: 2014. december 27 .
- BAUA: Az anyag tulajdonságainak értékelésének indoklása: Toluol (PDF; 151 kB), 2002. május 24.
Egyéni bizonyíték
- ↑ a b c d e f g h i j k l m n Entry a toluolt a GESTIS anyag adatbázisa az IFA , hozzáférhető a január 8, 2018. (JavaScript szükséges)
- ↑ David R. Lide (szerk.): CRC Handbook of Chemistry and Physics . 90. kiadás. (Internetes verzió: 2010), CRC Press / Taylor és Francis, Boca Raton, FL, Dipole Moments, 9-58.
- ^ Heinz GO Becker, Werner Berger, Günter Domschke: Organikum . 22. kiadás. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3 , 732.
- ↑ bevitel toluol az osztályozási és címkézési jegyzékbe az az Európai Vegyianyag-ügynökség (ECHA), elérhető február 1-jén, 2016. A gyártók és a forgalmazók is bővíteni a harmonizált osztályozás és címkézés .
- ↑ Svájci Balesetbiztosítási Alap (Suva): Határértékek-jelenlegi MAK és BAT értékek ( 108-88-3 vagy toluol keresése ), hozzáférés 2015. november 2-án.
- ^ J. Berzelius: Éves jelentés a kémia és az ásványtan fejlődéséről. 22, Lauppsche Buchhandlung, Tübingen 1843, 354. o., Online a babel.hathitrust.org címen, hozzáférés 2017. január 15 -én.
- ↑ Aug. Wilh. Hofmann: A benzolra adott biztonságos reakcióról. In: Liebigs Ann Chem , 55, 1845, 200-205. O., Doi: 10.1002 / jlac.18450550205 .
- ↑ Christian Wiegand: A fontos szerves triviális nevek eredete és értelmezése. I. Benzol sorozatú szénhidrogének. In: Angewandte Chemie . 60 (4), 1948, 109-111. O., Doi: 10.1002 / ange.19480600407 .
- ↑ H. Limpricht : Szerves kémia tankönyve. 2. kötet, CA Schwetske & Sohn, 1862, 791. o.
- ↑ Belépés a toluolra. In: Römpp Online . Georg Thieme Verlag, hozzáférés: 2017. március 26.
- ^ Richard L. Myers: A 100 legfontosabb kémiai vegyület. Greenwood Press, 2007, ISBN 978-0-313-33758-1 , 283. o.
- ↑ Houben-Weyl : Arene és Arine , 4. kiadás, Thieme, Stuttgart, 1981, 194. o. Korlátozott előnézet a Google könyvkeresésében
- ↑ a b I. M. Smallwood: A szerves oldószer tulajdonságainak kézikönyve. Arnold, London 1996, ISBN 0-340-64578-4 , 40-42.
- ^ A b M. V. Roux, M. Temprado, JS Chickos, Y. Nagano: Kritikusan értékelt termokémiai tulajdonságai a policiklusos aromás szénhidrogéneknek. In: J. Phys. Chem. Ref. Data . 37, 2008, 1855-1996.
- ↑ JD Cox, G. Pilcher: Szerves és fémorganikus vegyületek termokémiája. Academic Press, New York, 1970, ISBN 0-12-194350-X .
- ↑ a b J.-PE Grolier, G. Roux-Desgranges, M. Berkane, E. Jimenez, E. Wilhelm: Nagyon poláris anyagok keverékeinek hőkapacitása és sűrűsége 2. N, N-dimetilformamidot tartalmazó keverékek. In: J. Chem. Thermodyn. 25, 1993, 41-50.
- ^ A b D. W. Scott: Toluol: termodinamikai tulajdonságok, molekuláris rezgések és belső forgás. In: J. Phys. Chem. 66, 1962, 911-914.
- ↑ a b c d C Tsonopoulos; Ambrose, D.: Az elemek és vegyületek gőz-folyadék kritikus tulajdonságai. 3. Aromás szénhidrogének. In: J. Chem. Eng. Adatok . 40, 547-558 (1995). doi: 10.1021 / je00019a002
- ^ Carl L. Yaws, Prasad K. Narasimhan: Vegyszerek és szénhidrogének termofizikai tulajdonságai - 1. fejezet: Kritikus tulajdonságok és koncentrációs tényező, szerves vegyületek. 1. kiadás. Elsevier 2008, ISBN 978-0-8155-1596-8 , 31. o. Doi: 10.1016 / B978-081551596-8.50006-7
- ↑ ES Domalski, ED Hallás: Hőkapacitások és szerves vegyületek entrópiái a kondenzált fázisban. Kötet III. In: J. Phys. Chem. Ref. Data . 25, 1, 1996, doi: 10.1063 / 1.555985 .
- ^ A b V. Majer, V. Svoboda: A szerves vegyületek elpárologtatásának entalpiái: kritikai áttekintés és adatgyűjtés. Blackwell Scientific Publications, Oxford 1985, 300. o.
- ↑ a b c d e E. Brandes, W. Möller: Biztonsággal kapcsolatos paraméterek. 1. kötet: Gyúlékony folyadékok és gázok. Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Műszaki szabály a veszélyes anyagokra TRGS 727, BG RCI tájékoztató T033 Az elektrosztatikus feltöltődések miatti gyulladás elkerülése , állapot 2016. augusztus, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6 .
- ↑ Toluol az enius -tól , hozzáférés 2018. február 25 -én .
- ↑ P. Hoet, D. Lison: A toluol és a sztirol ototoxicitása: a jelenlegi ismeretek állapota. In: Crit Rev Toxicol. 38. kötet, 2008. 2. szám, 127-170. doi: 10.1080 / 10408440701845443 . PMID 18259983 .
- ↑ A 2006. december 18 -i 1907/2006/EK rendelet 67. cikke. L 136., 2007. május 29. (PDF) a XVII. Melléklet 48. bejegyzésével.
- ^ Európai Vegyianyag -ügynökség (ECHA): Anyagértékelő jelentés és záró dokumentum .
- ↑ Az Európai Vegyianyag -ügynökség (ECHA) közösségi gördülő cselekvési terve ( CoRAP ): Toluol , hozzáférés : 2019. március 26.