aceton
| Szerkezeti képlet | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Tábornok | |||||||||||||||||||
| Vezetéknév | aceton | ||||||||||||||||||
| más nevek | |||||||||||||||||||
| Molekuláris képlet | C 3 H 6 O | ||||||||||||||||||
| Rövid leírás |
színtelen folyadék, édes illattal |
||||||||||||||||||
| Külső azonosítók / adatbázisok | |||||||||||||||||||
| |||||||||||||||||||
| tulajdonságait | |||||||||||||||||||
| Moláris tömeg | 58,08 g mol -1 | ||||||||||||||||||
| Fizikai állapot |
folyadék |
||||||||||||||||||
| sűrűség |
0,79 g cm -3 (20 ° C) |
||||||||||||||||||
| Olvadáspont |
-95 ° C |
||||||||||||||||||
| forráspont |
56 ° C |
||||||||||||||||||
| Gőznyomás |
|
||||||||||||||||||
| oldhatóság |
vízzel és sok szerves oldószerrel elegyedik |
||||||||||||||||||
| Dipólmomentum | |||||||||||||||||||
| Törésmutató |
1,3588 (20 ° C) |
||||||||||||||||||
| biztonsági utasítások | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG / Svájc: 500 ml m −3 vagy 1200 mg m −3 |
||||||||||||||||||
| Toxikológiai adatok | |||||||||||||||||||
| Amennyire lehetséges és szokásos, SI egységeket használnak. Eltérő rendelkezés hiányában a megadott adatok a szabványos feltételekre vonatkoznak . Törésmutató: Na-D vonal , 20 ° C | |||||||||||||||||||
Aceton vagy aceton [ at͡sətoːn ] a közös neve a szerves-kémiai vegyület propanon vagy dimetil-keton . Az aceton színtelen folyadék, poláris aprotikus oldószerként és a szerves kémia számos szintézisének kiindulási anyagaként használják. A két metilcsoportot hordozó karbonilcsoport (> C = O) szerkezeti jellemzőivel a legegyszerűbb keton .
Kitermelés és bemutatás
Az acetont először 1606 -ban Andreas Libavius állította elő ólom (II) -acetát hevítésével . 1661 -ben Robert Boyle megnyerte a fa száraz lepárlásával. Úgy írták le először 1610-ben a Tyrocinium Chymicum által Jean Beguin . Század közepéig a Chaim Weizmann által felfedezett és szabadalmaztatott aceton-butanol-etanol fermentáció fontos folyamat volt az aceton előállításában is. A Clostridium acetobutylicum anaerob baktériumot ipari termelésre használták.
Az aceton legfontosabb gyártási folyamata ma a kumén -hidroperoxid -eljárás , amelyet Hock -fenol -szintézisnek is neveznek :
Itt a benzolt és a propént először izopropil- benzolrá ( kumén ) alakítják át egy savas Friedel-Crafts-alkilezéssel . Ez azután oxigénnel reagál egy gyökös reakcióban, és hidroperoxid keletkezik , amely savas feldolgozás során bomlik fenolra és acetonra.
Egy másik gyártási folyamat az izopropanol dehidrogénezése vagy oxidehidrogénezése .
Az aceton előállításának másik módja a kalcium -acetát ( 1 ) melegítése, ahol acetonra ( 2 ) és kalcium -oxidra bomlik ("mészsó desztilláció").
Ez a folyamat visszanyúlik Libavius 1606-ban említett történelmi szintéziséhez.
tulajdonságait
Az aceton színtelen, alacsony viszkozitású folyadék, jellegzetes, enyhén édes illatú, nagyon gyúlékony és robbanásveszélyes keveréket képez a levegővel. A forráspont normál nyomáson 56 ° C. Minden arányban elegyedik vízzel és a legtöbb szerves oldószerrel. Az aceton molekula keto-enol tautomerizmust mutat ; annak pK s értéke : 20. aceton oka lehet, hogy a poláros karbonilcsoport kationokkal is képezhetnek komplex vegyületek.
A vegyület azeotróp elegyet képez számos más oldószerrel . Az azeotróp készítményeket és forráspontokat az alábbi táblázat tartalmazza. Víz , etanol , 1-propanol , 2-propanol , n-butanol , benzol , toluol , etil-benzol , dietil-éter , etil-acetát és acetonitril nem képez azeotrópokat .
| Azeotrópok különböző oldószerekkel | ||||||||||||
| oldószer | n -pentán | n -hexán | n -heptán | Ciklohexán | Metanol | kloroform | Szén -tetraklorid | Diizopropil -éter | Metil -acetát | |||
| Az aceton tartalma | ban ben% | 21. | 59 | 90 | 67 | 88 | 22 -én | 89 | 61 | 50 | ||
| forráspont | ° C -ban | 32 | 50 | 56 | 53 | 55 | 64 | 56 | 54 | 55 | ||
Termodinamikai tulajdonságok
Szerint a Antoine, a gőznyomás függvény eredményeinek a log 10 (P) = A- (B / (T + C)) (P bar, T K-ben), ahol A = 4,42448 A, B = 1312,253 és C = -32,445 a a hőmérséklet -tartomány 259,2 és 507,6 K között van.
| jellegzetes | típus | Érték [egység] | Megjegyzések |
|---|---|---|---|
| A képződés standard entalpiája | Δ f H 0 folyadék Δ f H 0 gáz |
−249,4 kJ mol −1 −218,5 kJ mol −1 |
folyadékként, mint gáz |
| Az égés entalpiája | Δ c H 0 gáz | −1821,4 kJ mol −1 | |
| Hőkapacitás | c o | 125,45 J mol −1 K −1 (25 ° C) 2,16 J g −1 K −1 (25 ° C) 75,02 J mol −1 K −1 (25 ° C) 1,29 J g −1 K −1 (25 ° C) |
folyadékként, mint gáz |
| Kritikus hőmérséklet | T c | 508,15K | |
| Kritikus nyomás | p c | 47,582 bar | |
| Kritikus sűrűség | ρ c | 4,63 mol·l −1 | |
| Acentrikus tényező | ω c | 0,30653 | |
| A fúzió entalpiája | Δ f H | 5,72 kJ mol −1 | olvadáspontján |
| Párolgási entalpia | Δ V H | 29,1 kJ mol −1 | normál nyomású forrásponton |
A párolgási entalpia hőmérsékletfüggését a Δ V H 0 = A e (−βT r ) (1 - T r ) β (Δ V H 0 kJ / mol, T r = (T /) T c ) csökkentett hőmérséklet) A = 46,95 kJ / mol, β = 0,2826 és T c = 508,2 K esetén 298 K és 363 K közötti hőmérséklettartományban. A fajlagos hőteljesítmény az 5 ° C és 50 ° C közötti hőmérséklet -tartományban számítható ki egy lineáris függvény segítségével, c p = 1,337 + 2,7752 · 10 −3 · T (c p -vel kJ · kg −1 · K −1 és T in K) megbecsülhető.
Gőznyomás -Az aceton működése
Az aceton párolgási entalpiájának hőmérsékletfüggése
Az aceton fajlagos hőkapacitása
Biztonsággal kapcsolatos paraméterek
Az aceton tűzveszélyes gőz-levegő keveréket képez. A vegyület lobbanáspontja -20 ° C alatt van. A robbanási tartomány 2,5 térfogatszázalék (60 g / m³), mint alsó robbanási határ (LEL) és 14,3 térfogatszázalék (345 g / m³), mint felső robbanási határ (UEL). A robbanási határok és a gőznyomás függvénye közötti korreláció azt eredményezi, hogy az alsó robbanáspont -23 ° C, a felső pedig 8 ° C. A robbanási határok nyomásfüggők. A nyomáscsökkenés a robbanási terület csökkenéséhez vezet. Az alsó robbanási határ csak kismértékben változik 100 mbar nyomásig, és csak 100 mbar alatti nyomáson nő. A felső robbanási határ a nyomás csökkenésével analóg módon csökken.
| Robbanási határok csökkentett nyomáson (100 ° C -on mérve) | ||||||||||||
| nyomás | mbar -ban | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 -én |
| Alsó robbanási határ (LEL) | térfogat% -ban | 2.2 | 2.2 | 2.3 | 2.3 | 2.4 | 2.4 | 2.5 | 2.6 | 2.7 | 3.6 | 5.0 |
| g m −3 -ban | 53 | 53 | 53 | 55 | 57 | 58 | 59 | 61 | 63 | 86 | 119 | |
| Felső robbanási határ (UEL) | térfogat% -ban | 14.3 | 14,0 | 13.7 | 13.4 | 13.2 | 13.1 | 13.1 | 13.1 | 12.5 | 10.3 | 9.0 |
| g m −3 -ban | 345 | 338 | 331 | 324 | 319 | 316 | 316 | 316 | 302 | 249 | 217 | |
| Maximális robbanási nyomás csökkentett nyomáson | ||||||||||||
| nyomás | mbar -ban | 1013 | 800 | 600 | 400 | 300 | 200 | 100 | ||||
| Maximális robbanási nyomás (bar) | 20 ° C -on | 9.3 | 7.5 | 5.5 | 3.6 | 2.7 | 1.8 | 0.8 | ||||
| 100 ° C -on | 7.4 | 4.5 | ||||||||||
A maximális robbanási nyomás 9,7 bar. A hőmérséklet emelkedésével és a kimeneti nyomás csökkenésével a maximális robbanási nyomás csökken. A határrés szélessége 1,04 mm (50 ° C) volt. Ennek eredményeként a IIA robbanási csoportba sorolható. A minimális gyújtási energiája 1,15 mJ, gőz-levegő keverékek rendkívül gyúlékony. A gyújtási hőmérséklet 535 ° C. Az anyag ezért a T1 hőmérsékleti osztályba tartozik . Megnövekedett nyomás esetén a gyújtási hőmérséklet éles csökkenése figyelhető meg. Az elektromos vezetőképesség meglehetősen alacsony , 4,9 · 10–7 S · m -1 .
| Gyulladási hőmérséklet fokozott nyomás alatt | ||||||||||||
| nyomás | készpénzben | 1 | 2 | 4. | 6.8 | 16.5 | ||||||
| Gyulladási hőmérséklet | ° C -ban | 535 | 345 | 290 | 265 | 250 | ||||||
Reakciók (kiválasztás)
Az aceton jódozása
Különleges reakcióként itt az aceton jódozása a pszeudo-nulla rendű reakciókinetika klasszikus példája . Mivel csak az enol forma jódozható, de az aceton majdnem 100% keton, a 2-propenol koncentrációja a reakció során állandónak tekinthető. C = C kettős kötése reagál a jóddal azáltal, hogy egy jodidiont szétválasztva mezomer kationt képez, amely ezután egy protont jodidionra továbbít.
A keto-enol egyensúly létrejötte sav (és bázis) katalizátor. A jódozást ezért nagyban felgyorsítja a keletkező hidrogén -jodid ( autokatalízis ).
Jodoformos reakció
Bázis hozzáadásakor azonban a jodoform reakció megy végbe:
Dibenzalaceton képződése
Az aceton lúgos oldatban benzaldehid jelenlétében reagál, és dibenzalacetont képez . A reakció az aldol kondenzáció általános mechanizmusa szerint megy végbe .
A benzalanilin szintetizálható is - az anilint a víz lúgos oldatának acetonnal történő eltávolításával reagálja a Schiff -bázisra ( azometin ). Mind a dibenzalaceton, mind a benzalanilin értékes anyagok, mivel nagyon reakcióképes kettős kötéseket tartalmaznak , amelyeket nukleofilek megtámadhatnak.
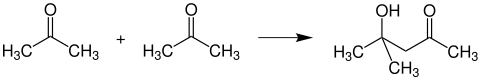
Diaceton -alkohol képződése
Ha két acetonmolekulát hagyunk aldolszerű módon dimerizálódni bázikus reagensek hatására, akkor diaceton-alkohol képződik :
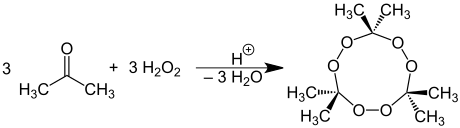
Aceton -peroxid képződése
Az aceton hidrogén-peroxiddal reagálva detonációra hajlamos aceton-peroxidot képez :
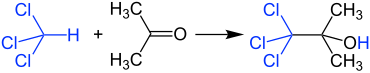
Reakció kloroformmal
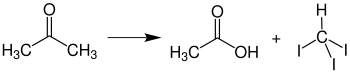
Az acetont és a kloroformot nem szabad nagyobb koncentrációban keverni, mert nagyon heves reakció lép fel lúgos anyagok nyomában, és 1,1,1-triklór-2-metil-2-propanolt termel . Emiatt a klórozott és nem klórozott oldószer-hulladékot is külön kell gyűjteni a laboratóriumban.
használat
Az aceton a vegyipar számos szintézisének kiindulási anyaga. Elsősorban polimetil -metakrilát (PMMA) előállítására használják, köznyelven akrilüveg vagy plexiüveg néven ismert. Ebből a célból az acetont először hidrogén -cianid hozzáadásával aceton -cianohidrinné alakítják át, amely savas környezetben könnyen elválasztja a vizet ( a kettős kötés mezomer stabilizációja a nitrilcsoport hármas kötéséhez való konjugáció miatt). Az így kapott 2-methylpropenenitrile alakítjuk , hogy metil-metakrilát keverékét adtuk tömény kénsav és metanol , amely polimerizáljuk akrilüveg egy további lépésben.
Acetont iparilag prekurzorként termelésére diaceton-alkohol által aldol hozzáadásával , és így közvetve prekurzorként mezitil-oxid és metil-izobutil-keton .

Az acetont kis mennyiségben gyanták , zsírok és olajok, gyanta , cellulóz -acetát hasznos oldószereként , valamint körömlakklemosóként és műanyag ragasztóként is használják. Azt is használják, hogy távolítsa el szennyeződés okozta építőipari hab, például, ha tisztítás PU hab fegyvert. Térfogatának többszörösét etilénben (acetilénben) oldja .
Egyes országokban kis mennyiségben (1: 2000 - 1: 5000) acetont adnak a benzinhez vagy a dízelhez az üzemanyag teljesebb elégetése érdekében.
A fotokémiai áramköri lapok gyártásakor acetont használnak az áramköri lap végső zsírtalanítására forrasztás előtt.
A fogászatban acetont tartalmazó oldatokat használnak az előkészített dentinfelületek és gyökércsatornák tisztítására .
biokémia
Az aceton a májban képződött ketontest , amely nem metabolizálható jelentős mértékben. Ezért szabadul fel a tüdőben , vagy kivételes esetekben , a vizelet ( acetonuria egy tünete a diabetes mellitus ). További ketontestek az acetoacetsav és a 3-hidroxi-butánsav . Ezek feldolgozhatók az anyagcserében, és részt vesznek az izmok energiaellátásában.
toxikológia
Az aceton kiszáradást okoz a bőrön, mivel zsírtalanítja a bőrt. Ezért érintkezés után zsírozza meg az érintett területeket. Nagyobb adagok belégzése hörgőirritációt, fáradtságot és fejfájást okoz. A nagyon nagy dózisoknak narkotikus hatása van .
Hexadeuteroaceton
Deuterált acetont (empirikus képlet: C 3 D 6 O), más néven aceton-d 6 -ot használnak oldószerként a nukleáris mágneses rezonancia spektroszkópiában (NMR).
A fizikai tulajdonságok kissé eltérnek a nem deuterált vegyülettől:
- Olvadáspont: -93,8 ° C
- Forráspont: 55,5 ° C
- Sűrűség: 0,872 g / ml (25 ° C)
- Törésmutató: 1,355 (20 ° C)
web Linkek
- Az aceton bejegyzése a fogyasztói termékinformációs adatbázisba
Egyéni bizonyíték
- ↑ bevitel ACETONBAN a CosIng adatbázisa az Európai Bizottság, elérhető február 16-án, 2020-ra.
- ↑ a b c d e f g h i j k l m n o Entry on acetont a GESTIS anyag adatbázisa az IFA , hozzáférhető a február 1, 2016. (JavaScript szükséges)
- ↑ Peter B. Fleming, Robert E. McCarley: A többmagvú fémhalogenidek kémiája. IV. Néhány niobium és tantál M 6 X 12 n + klaszter -származékok elektronikus spektruma . In: Szervetlen kémia . szalag 9 , nem. 6. , 1970. június, p. 1347-1354 , doi : 10.1021 / ic50088a011 .
- ↑ Bevezetés acetonra. In: Römpp Online . Georg Thieme Verlag, hozzáférés 2014. november 10 -én.
- ↑ David R. Lide (szerk.): CRC Handbook of Chemistry and Physics . 90. kiadás. (Internet verzió: 2010), CRC Press / Taylor és Francis, Boca Raton, FL, Dipole Moments, 9-52.
- ↑ David R. Lide (szerk.): CRC Handbook of Chemistry and Physics . 90. kiadás. (Internet verzió: 2010), CRC Press / Taylor és Francis, Boca Raton, FL, Physical Constants of Organic Compounds, 3-4.
- ↑ bevitel acetont a Osztályozási és címkézési jegyzék az az Európai Vegyianyag-ügynökség (ECHA), elérhető február 1-jén, 2016. A gyártók és a forgalmazók is bővíteni a harmonizált osztályozás és címkézés .
- ↑ Svájci Balesetbiztosítási Alap (Suva): Határértékek-jelenlegi MAK és BAT értékek ( 67-64-1 vagy aceton keresése ), hozzáférés 2015. november 2-án.
- ↑ chemgapedia.de , tanuló egység aceton szintézis.
- ↑ a b I. M. Smallwood: A szerves oldószer tulajdonságainak kézikönyve. Arnold, London 1996, ISBN 0-340-64578-4 , 27-29.
- ↑ D. Ambrose, CHS Sprake, R. Townsend: A szerves oxigénvegyületek termodinamikai tulajdonságai. XXXIII. Az aceton gőznyomása. In: J. Chem. Thermodyn. 6, 1974, 693-700, doi: 10.1016 / 0021-9614 (74) 90119-0 .
- ↑ a b K. B. Wiberg, LS Crocker, KM Morgan: Thermochemical Studies of Carbonyl Compounds. 5. A karbonilcsoportok redukciójának entalpiái. In: J. Am. Chem. Soc. 113, 1991, 3447-3450, doi: 10.1021 / ja00009a033 .
- ^ CB Miles, H. Hunt: Az égés hevei. I. Az aceton égésének hője. In: J. Phys. Chem. 45, 1941, 1346-1359. doi: 10.1021 / j150414a002 .
- ↑ a b c R. Malhotra, LA Woolf: A propanon (aceton) termodinamikai tulajdonságai 278 K és 323 K közötti hőmérsékleten és 400 Mpa nyomáson. In: J. Chem. Thermodyn. 23, 1991, 867-876, doi: 10.1016 / S0021-9614 (05) 80282-4 .
- ↑ a b J. Chao: A legfontosabb szerves oxigénvegyületek termodinamikai tulajdonságai a C 1 - C 4 széntartományban . 2. rész: Ideális gáztulajdonságok. In: J. Phys. Chem. Ref. Data . 15, 1986, 1369-1436, doi: 10.1063 / 1.555769 .
- ↑ a b c A. N. Campbell, RM Chatterjee: Az aceton, a kloroform -benzol és a szén -tetraklorid kritikus állandói és ortobáris sűrűsége . In: Canadian Journal of Chemistry . 47, 1969, 3893-3898, doi : 10.1139 / v69-646 .
- ↑ J. Schmidt: Biztonsági szelepek tervezése többcélú rendszerekhez az ISO 4126-10 szerint. In: Chem. Ing. Techn. 83, 2011, 796-812. O., Doi: 10.1002 / cite.201000202 .
- ↑ KK Kelley: Az izopropil -alkohol és az aceton 16 és 298 ° K közötti hőmérséklete, valamint a megfelelő entrópiák és szabad energiák. In: J. Am. Chem. Soc. 51, 1929, 1145-1150, doi: 10.1021 / ja01379a022 .
- ^ A b V. Majer, V. Svoboda: A szerves vegyületek elpárologtatásának entalpiái: kritikai áttekintés és adatgyűjtés. Blackwell Scientific Publications, Oxford 1985, 300. o.
- ↑ a b c d e E. Brandes, W. Möller: Biztonsággal kapcsolatos paraméterek. 1. kötet: Gyúlékony folyadékok és gázok. Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b c d D. Pawel, E. Brandes: A kutatási projekt zárójelentése, a biztonsággal kapcsolatos paraméterek függése a légköri nyomás alatti nyomástól. ( Memento 2013. december 2-tól az Internet Archívumban ), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- ↑ JB Fenn: Szegény gyúlékonysági határ és minimális szikragyújtási energia. Kereskedelmi folyadékok és tiszta szénhidrogének. In: Ind. Eng. Chem. 43, 1951, 2865-2869; doi: 10.1021 / ie50504a057 .
- ↑ HF Calcote, CA Gregory, CM Barnett, RB Gilmer: Spark Ignition - Effect of Molecular Structure. In: Ind. Eng. Chem. 44, 1952, 2656-2662; doi: 10.1021 / ie50515a048 .
- ↑ Műszaki szabály a veszélyes anyagokra TRGS 727, BG RCI tájékoztató T033 Az elektrosztatikus feltöltődések miatti gyulladás elkerülése , állapot 2016. augusztus, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6 .
- ^ FA Carey, RJ Sundberg: Szerves kémia. Wiley-VCH Verlag, 2004, ISBN 3-527-29217-9 .
- ↑ Lutz Roth, Ursula Weller: Veszélyes kémiai reakciók , ISBN 3-609-73090-0 , biztonság; 2005.
- ↑ Külső azonosítók vagy adatbázis linkek a deuterezett acetonhoz : CAS -szám :666-52-4 , EK-szám: 211-563-9, ECHA InfoCard : 100.010.514 , PubChem : 522220 , ChemSpider : 455535 , Wikidata : Q1032873 .
- ↑ aceton-d6 adatlap a Sigma-Aldrich , hozzáférhető a 31 augusztus 2019 ( PDF ).
- ↑ A nem deuterált vegyület 0,791 g / ml-ével (25 ° C) összehasonlítva. Aceton adatlap a Sigma-Aldrich-tól , hozzáférés 2019. augusztus 31-én ( PDF ).