Aminok
Amikor aminok vannak a szerves vegyületek említett, amelyek végső soron származékok ammónia (NH 3 a), és amelyben egy, kettő vagy mind a három hidrogénatom ammónia által alkilcsoport vagy arilcsoport kicserélik vagy, hogy többé-kevésbé eltérő heterociklusos gyűrű rendszerek gyere össze. Mivel az aminok egynél több nitrogénatomot is tartalmazhatnak, a lehetséges aminok száma olyan nagy, és szerkezetük annyira különbözik, hogy a szerkezeteket és a tulajdonságokat nem lehet egyetlen cikkben bemutatni. A ciklikus aminokat csak elmulasztva említik; ezért hivatkozunk a Heterocyclen cikkre .
A nem ciklikus aminok szisztematikája
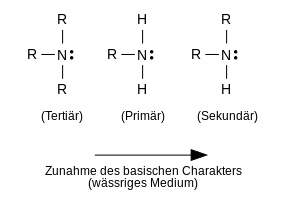
Általában meg lehet különböztetni a nem ciklikus aminok három fő típusát. Az ammóniában szerves alkil- vagy arilcsoportokká cserélt hidrogénatomok száma szerint az elsődleges, szekunder és tercier aminokról beszélünk. Az N-atomhoz kötött csoportok típusától függően ez a három típus pontosabban alifás, aromás vagy kevert alifás-aromás aminokként is emlegethető. Ha az N atomhoz kötött C atom egy CC kettős kötés része, mint pl. B. ethenaminban a helyzet bonyolult, mert az ilyen vegyületek tautomer formákat képeznek .
Az aminok két N atomot (aminocsoportot) is tartalmazhatnak, amelyek különböző szénatomokhoz vannak kötve; akkor az ember diaminokról beszél , amelyek szintén különböző típusúak lehetnek. Ha - mint egy alifás, szekunder amin esetében - két alkilcsoport kapcsolódik egy N atomhoz, akkor mindkét alkilcsoport gyűrű képződésével is lezárható. Ezután ciklikus szekunder aminokról beszélünk, mint pl. B. piperidin . A gyűrűzárás történhet diaminok esetében is, pl. B. piperazin . Az ilyen gyűrűs rendszerben CC kettős kötés nélküli ciklikus aminok a heterociklusos aminok nagyon nagy és nagyon változó csoportjába tartoznak, de úgy viselkednek, mint a normál, nem ciklikus aminok.
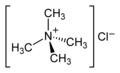
Az összes amin alkilezéssel kvaterner ammóniumvegyületekké alakítható . A kvaterner ammóniumvegyületek tehát nem aminok, hanem a vegyületek további, külön csoportjába tartoznak, amelyek a megfelelő aminokból származnak. A végén a táblázatban látható kvaterner ammóniumvegyület tehát nem amin, hanem a legegyszerűbb típusú kvaterner ammóniumsó.
| Aminok és ammóniumsók | |||||
|---|---|---|---|---|---|
| Típusok | Funkcionális csoport | példa | |||
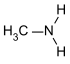
| primer aminok | R-NH 2 | elsődleges aminocsoport | R-NH 2 | Metil-amin |
|
| másodlagos aminok | RNH-R | szekunder aminocsoport | R-NH-R | Dimetil-amin |

|
| tercier aminok | NR 3 | tercier aminocsoport | R-NR 2 | Trimetil-amin |

|
| aminok nincsenek, hanem kvaterner ammóniumvegyületek |
NR 4 + (X - ) | kvaterner ammóniumcsoport | R-NR 3 + |
Tetrametil - ammónium- klorid |
|
| További példákért lásd : kategória: amin és kategória: kvaterner ammóniumvegyület | |||||
tulajdonságait
Kémiai tulajdonságok
Alifás aminok
Az ammóniához hasonlóan az összes alifás amin többé-kevésbé erős bázis, mert egy proton kapcsolódhat az N atom egyedüli elektronpárjához . Az intézkedés a bázis erőssége az amin a bázis állandója az amin vagy a sav állandója a kapcsolódó ammónium-kation, által kifejezett értéke a bázis vagy a értéke ammónium kation. Ezek az értékek információt nyújtanak a primer amin víz általi protonálásának következő egyensúlyi helyzetéről, és így az amin báziserősségéről vagy a kapcsolódó ammónium kation savtartalmáról:
Mivel a protonálással előállított ammónium-kationok általában jobban oldódnak vízben, mint az eredeti aminok, vizes sósavval történő extrakció a legegyszerűbb módszer az aminok elválasztására más nem bázikus szerves anyagoktól. A helyettesítés típusa és a helyettesítés mértéke erősen befolyásolhatja az aminok alaposságát. Alifás aminokban az alkilcsoportok, mint szubsztituensek, növelik az elektron sűrűségét a nitrogénatomon, "elektronadományozó" hatásuk miatt ( induktív hatás , + I hatás ). Arra lehet tehát számítani, hogy az N atom egyedüli elektronpárja egyre könnyebben protonálódik, amikor az N atomon lévő alkilcsoportok száma (szubsztitúciós fok) megnő. Ez azonban csak akkor érvényes, ha nincs más zavaró hatás - például B. a aminok és a vízmolekulák által képzett ammónium-kationok hidratációja hatékonnyá válik. Ha nincsenek zavarok, akkor az úgynevezett gázfázis savasságról beszélünk . Ilyen vízmentes körülmények között az alifás aminok lúgossága a várakozásoknak megfelelően növekszik a növekvő helyettesítéssel. Ez azt jelenti, hogy az alifás aminok erősebb bázisok, mint az ammónia, a következő sorrendben:
Ammónia <elsődleges <másodlagos <tercier.
Víz jelenlétében az ammónia, az aminok és az ammónium-kationok hidratálása hidratációs hőt bocsát ki, nagyrészt primer aminokkal, legkevésbé harmadlagos aminokkal. Az egyre növekvő mértékű helyettesítéssel a hidratálás nyilvánvalóan szterikusan akadályozott. Ezek a hatások megváltoztatják a vizes oldatok bázissági sorrendjét:
Vizes oldatban az alifás aminok a következő lúgos sorrendet mutatják:
harmadlagos <elsődleges <másodlagos.
A leírt gradációk és a tercier aminok lényegesen alacsonyabb lúgossága vizes oldatokban tükröződik az ammónia és a három legegyszerűbb alkilamin értékében és értékeiben is .
- Ammónia: 9,25; = 4,75;
- Metil-amin : 10,6; = 3,4; (az összes primer alifás amin hasonló értékekkel rendelkezik).
- Dimetil-amin : 10,8; = 3,2;
- Trimetil-amin : 9,8; = 4,2;
Aromás aminok
Míg az alifás aminok lúgossága az alkilcsoportok + I hatása miatt nagyobb, mint az ammóniaé, az aromás aminok lúgossága lényegesen alacsonyabb, mint az ammónia lúgossága. Ezért a legegyszerűbb aromás aminanilin értéke 9,37, ami lényegesen magasabb, mint az ammóniaé 4,75. Az egyedüli elektronpárnak a fenilgyűrű aromás rendszerében található nitrogénatomon történő elhelyezkedése stabilizálja a deprotonált formát, és az aromás aminok lényegesen kevésbé bázikusak, mint az ammónia vagy az alifás aminok (formailag −M hatás). Az anilin aromás gyűrűrendszerén található egyéb elektronelvonó szubsztituensek - mint pl. B. a nitrocsoport a nitroanilin- drasztikusan csökkentheti a bázicitás még tovább.
Heterociklusos aminok
A gyűrűs aminok tulajdonságai nagyon különbözőek a gyűrűrendszerek típusától függően, amelyek több különböző módon kapcsolt, a legváltozatosabb típusú gyűrűrendszerből állhatnak, és nem írhatók le általánosabban. Tehát viselkedj z. B. ciklikus aminok nem aromás gyűrűrendszerekkel kettős kötések nélkül, mint pl. B. piperidin , például normál szekunder, alifás aminok. Ezzel szemben a gyűrűrendszerrel és három konjugált kettős kötéssel rendelkező ciklikus amin, a piridin , nem úgy viselkedik, mint egy normál tercier alifás amin. Az ilyen típusú aminok szintén bázisok, de nagyon eltérő tulajdonságokkal rendelkeznek, és egy új vegyületcsoportot alkotnak: aromás, heterociklusos aminokat.
Fizikai és fiziológiai tulajdonságok
Alifás aminok, mint például monometil- , dimetil-amin és a trimetil-amin , valamint etil-amin gázalakú szobahőmérsékleten. Sok más homológ vegyület folyékony és néhány még magasabb homológ amin, például pl. B. A decilamin szobahőmérsékleten szilárd.
A legegyszerűbb aromás aminanilin folyékony. Sok szubsztituált anilin és más aromás amin számos aromás gyűrűrendszerrel, például. B. A naftil-amin szilárd.
Polaritásuk és lúgosságuk miatt az aminok jobban oldódnak a vízben, mint az azonos szénatomszámú szénhidrogének. Az alifás aminok vízoldékonysága az alkiláncok hosszának növekedésével csökken. Az aromás aminok nem oldódnak vízben. A folyékony primer és szekunder alifás és aromás aminok hidrogénkötésekkel társulnak . Az alkoholokhoz hasonlóan ez magasabb forrásponthoz vezet az analóg szénhidrogénekhez képest.
A gáznemű alifás aminok irritálják a szem nyálkahártyáját és a légzőrendszert. Ha a bőrt folyékony alkil-aminokkal nedvesítik, kémiai égési sérülések is előfordulnak. A nagyobb koncentrációk belégzésével történő mérgezés a vérnyomás emelkedését és rövid távú görcsöket okozhat. Az aromás aminok alacsonyabb lúgosságuk és alacsonyabb illékonyságuk miatt nem irritálóak, de lényegesen mérgezőbbek, mint az alifás aminok, pl. B. anilin .
A gáznemű alifás aminoknak az ammóniához hasonló, de „halas, rothadt” illata is van. A magasabb homológoknak és az aromás vagy heterociklusos aminoknak olyan szaguk is van, amelyet az emberek kellemetlenül érzékelnek, például széklet ( indol , skatol ) vagy bomló hús ( kadaverin , putreszin ), vizelet vagy régi halak ( metil , etil és trimetilamin ). Ilyen vegyületek keletkezhetnek köztitermékként vagy végtermékként a biológiai anyag, különösen a fehérjék anaerob lebontásában vagy az aminosavak dekarboxilezésében . A jellegzetes szaga spermium van spermin lineáris poliamin - - két primer és két szekunder aminocsoport, felelős.
Másrészt sok gyógyszer szintén az aminok csoportjába tartozik, különösen gyakran a heterociklusos aminok alcsoportjába, mint pl. B. atropin , amfetamin , kinin , kodein és koffein , de olyan gyógyszerek is. B. metamfetamin , kokain , nikotin .
Gyártás, alkotás
Az az elképzelés, hogy az aminok ammónia alkilezésével z. A B. könnyen alkil-halogenidekkel reprezentálható , tévhit, nemcsak azért, mert az ammónia gáznemű. Az ammónia alkilezése az összes alkilezési lépés keverékét eredményezné, mivel az eredetileg képződött primer aminokat még előnyösebben tovább szekunder aminokká, ezeket tercier aminokká, végül pedig kvaterner ammóniumsókká alakítják.
Elsődleges aminok
A primer aminok célzott előállításához a következő fontos módszerek állnak rendelkezésre:
- A Gabriel-szintézist gyakran használják. Ebben a reakcióban a ftalimidet először a megfelelő alkil-halogeniddel reagáltatjuk, majd a kapott alkil-ftalimidet nátrium-hidroxid-oldattal hidrolízissel vagy jobb esetben hidrazinnal hidrazinolízissel dolgozzuk fel az elsődleges amin felszabadítása érdekében.
- Alternatívaként, az alkil-halogenidek is reagáltathatjuk a nátrium-aziddal , így alkil-azidok , amelyek ezt követően csökken , hogy primer aminok a lítium-alumínium-hidrid .
- Lánchosszabbítással egy alkil-halogenidet nátrium-cianiddal reagáltatva nitrilt képeznek , amelyet ezután primer aminokká redukálnak.
- A karboxamid lebontásának Hofmann- módszere primer aminokat is termel, bár a szénláncot egy szénatom rövidíti meg.
- A primer aminok láncrövidítéssel történő szintetizálásának másik módja a Curtius-reakció , amelyben az amint egy acil-hidrazid lebontásával állítják elő.
Másodlagos aminok
- A szekunder aminok állíthatók elő primer aminok reakciójával a primer amin R'-NH2 egy aldehiddel R-CH = O, hogy kialakítsuk a imin (R-CH = N-R „), amelyet azután csökken a szekunder amin által hidrogénezésével a kettős kötés válik.
Harmadlagos aminok
A Leuckart-Wallach reakció alkalmas tercier aminok előállítására .
Aromás aminok
Az aromás aminokat nitrálással és ezt követő redukcióval állítják elő (például anilin , toluidin ).
Műszaki eljárások
- Az aminok előállításának technikai folyamatai az ammónia alkoholokkal történő reakciói (→ lásd: alkoholos aminálás ). B. alkil-aminok, például metil- és etil-amin, amelyeket ezután el kell választani. Az aldehidek vagy ketonok reagáltathatók ammóniával, z-vel. B. Izopropilaminok keletkeznek. Különösen a finom vegyi anyagok és a kvaterner ammóniumsók képződnek klóralkánnal végzett további alkilezéssel.
- A nitrilek redukciója z-t ad. B. zsíros aminok
- Az epoxidok aminokkal vagy ammóniával történő reakcióját ipari léptékben hajtják végre. Ezzel etanol-aminokat , izopropanol- aminokat stb.
- Az alkánok nitrálása és az azt követő alkil-amin-redukció és az olefinek hidroaminálása ipari szempontból kevéssé fontos. Mindkettőjüket azonban ipari méretben is üzemeltetik.
Biológiai folyamatok
- Biológiai folyamatokban az aminok az aminosavak dekarboxilezésén keresztüli lebomlási és rothadási folyamatokból származhatnak .
A fehérjében megkötött aminosavak (pl. Halakból ) biokémiai úton aminokká és széndioxiddá bomlanak le az állatok pusztulása után . Az aminok felelősek a halak jellegzetes szagáért, amelyet néha kellemetlenül érzékelnek. A halakat gyakran egy szelet citrommal tálalják. Mint minden sav, a citromsav is protonálja az aminokat citrátok (citromsav sói) képződésével, és így csökkentheti az amin szagát.
Esemény
- Az aminok természetes módon fordulnak elő növényekben, állatokban és emberekben, majd biogén aminoknak nevezik őket, amelyek dekarboxilezéssel aminosavakból képződhetnek. A biogén aminok nagy jelentőséggel bírnak, mint a szöveti hormonok , mint pl B. hisztamin és szerotonin , amelyek a hisztidin és a triptofán aminosavakból származnak . Ez a két aminosav a bázikus aminosavakhoz tartozik, amelyeket a kötelező α-aminocsoport mellett további aminosavak jellemeznek. A hisztidinben a további bázikus csoport a heterociklusos amin- imidazol gyűrűje , a triptofánban a további bázikus csoport a heterociklusos amin- indol .
- A katekolaminok , amelyek magukban foglalják a primer alifás aminokat, a dopamint és a noradrenalint , neurotranszmitter anyagként írhatók le . Mindkét vegyület egy további aromás gyűrűrendszert is tartalmaz. Az adrenalin nagyon hasonlít a noradrenalinhoz, de a nitrogénatomon is metilezett, ezért másodlagos alifás amin.
- Ezenkívül megtalálhatók a heterociklusos aminok, mint például a purin és a pirimidin , úgynevezett nukleáris bázisokként a DNS nukleozidjainak alapvető szerkezeti komponenseiben .
- Az aminosavak, a peptidek építőkövei , sem aminok, sem karbonsavak. Bár tartalmazzák a két vegyületosztály funkcionális csoportjait, nem mutatják jellemző tulajdonságukat.
Kémiai reakció
Az aminok salétromsavval reagálva különböző termékeket képeznek, az alkalmazott amin típusától függően.
- Az elsődleges alifás és aromás aminok diazóniumsókat képeznek , amelyeket különféle módon lehet felhasználni kiindulási anyagként további szintézisekhez.
- A szekunder aminok úgynevezett nitrozáló szerekkel ( salétromsav , nitrogén-oxidok , nitritek ) reagálnak , különösen savas környezetben, például az emberi gyomorban található nitrozaminok képződésével . Mivel a táplálékban másodlagos aminok fordulnak elő, a nitrozaminok pedig rákkeltő hatásúak, ez a reakció figyelmet érdemel.
A tercier alifás aminok is képesek lassan reagálni a nitrozaminokra egy alkilcsoport eltávolításával; aromás tercier aminok reagálnak az aromás gyűrűrendszer elektrofil nitrozáló ágenseivel, és aromás nitrozovegyületek képződnek .
- Elektronban gazdag vegyületekként az aromás aminok reaktív reaktánsok az elektrofil aromás szubsztitúciókhoz .
- Aminok reagensek számos nukleofil szubsztitúciós reakciók, például a kialakulását a karboxamidok , carboximides vagy laktámok és iminek . Ezért az aminok a karbonil-vegyületek védőcsoportjaiként vagy királis segédanyagokként használhatók .
- Az elimináció során terjedelmes szekunder vagy tercier aminokat használnak proton akceptorként, amelyek bázikusak, de nem nukleofilek.
- Az aminokat, főleg diaminokat vagy triaminokat, ligandumként is használják a komplex kémia során .
használat
- Aromás aminokat használnak az azoszínezékek készítéséhez .
- Az aminok az agrokémiai és gyógyszeripari termékek, valamint a felületaktív anyagok , bevonatok és kenőanyagok építőkövei .
- Az öntödei technológia területén aminokat használnak katalizátorként, hogy felgyorsítsák a kötőanyagok keményedési folyamatát a formázó homokban a maggyártás során a hideg dobozos eljárással.
- Az aminok és diaminok katalizátorként is szolgálnak a poliuretánok előállításához és térhálósításához . Pufferhatásukat akkor alkalmazzák, ha vizes rendszerekben korróziógátlóként használják őket.
- Az aminok másik fontos alkalmazási területe a finomítói és erőművi gázmosás.
Az aminok kimutatása
- A szerves vegyületben lévő nitrogén kimutatásához a vizsgálandó anyag nátrium-bontása végezhető. A semlegesített feltáró oldatból, nitrogén is kimutatható -cianidot a Lassaigne minta , mint Berlin kék , vagy, ha az anyag is tartalmazott kén, mint tiocianát a vas (III) klorid . Ez a bizonyíték azonban nem jellemző az aminokra, csak arra utal, hogy a vizsgálandó anyag nitrogént tartalmazott.
- Az aminokat gyakran fel lehet ismerni jellegzetes csípős vagy kellemetlen szaguk alapján (ammóniához hasonlóan a halakig). De ez nem elég a bizonyításhoz.
- Az amin szubsztitúciójának mértékének meghatározásához , vagyis hogy van-e primer, szekunder vagy tercier amin, a Hinsberg-szétválasztást végezzük. Az amin p- toluolszulfonsavamiddá alakul át :
A tercier aminok és a kvaterner ammóniumsók nem képeznek szulfonamidokat, a
szekunder aminok szulfonamidokat képeznek, amelyek nem oldódnak lúgban, a
primer aminok szulfonamidokat képeznek, amelyek oldhatók lúgban.
- Az ismeretlen amin egyértelmű azonosítását tömegspektrometriával vagy megfelelő származékkal végezzük, amelynek jellemző olvadáspontját meghatározzuk:
- Primer és szekunder aminok: A Hinsberg-szétválasztás során már kapott szulfonamid alkalmas származékként (lásd fent).
- Tercier aminok: Itt a pikrátok kicsapása ajánlott.
A primer, szekunder és tercier aminok kromatográfiás úton szétválaszthatók derivatizálás nélkül HPLC alkalmazásával . A detektálás és a mennyiségi meghatározás tömegszelektív detektorral (HPLC / MS) történik. Az azonos moláris tömegű aminok (pl. Dietil-amin és butil-amin ) egyértelmű meghatározásához standard anyagok használata ajánlott a kalibráláshoz.
Lásd még
irodalom
- Hans Beyer , Wolfgang Walter: A szerves kémia tankönyve. 22. kiadás. 1991, ISBN 3-7776-0485-2 .
- Szerzői közösség: Organikum. 22. kiadás. Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3 .
- Karl Schwister: A kémia zsebkönyve. Hanser Fachbuchverlag, 2004.
Megjegyzések
web Linkek
- Növényi aminok .
- Az aminok alapvető karakterének magyarázata a TutorVista.com webhelyen (angol nyelven).
- Különböző aminok pK b értékű táblázatai .
Egyéni bizonyíték
- ↑ Jonathan Clayden, Stuart Warren, Nick Greeves, Peter Wothers: Szerves kémia . Oxford University Press, New York, 2001, ISBN 0-19-850346-6 , pp. 199-200 .
- Fred Louis Frederick Fieser , Mary Fieser: A szerves kémia tankönyve. 3. kiadás, Verlag Chemie, 1957, 254. o.
- ↑ A nitrozaminok bejegyzése . In: Römpp Online . Georg Thieme Verlag, hozzáférés: 2014. június 13.