Szabályozási ügyek
A gyógyszer-engedélyezési egy hivatalosan kiadott jóváhagyást , amely szükséges ahhoz, hogy képes legyen ajánlatot, eladni vagy kijuttató iparilag gyártott, kész használható gyógyszer . A gyógyszer -jóváhagyást csak egy adott indikációra (azaz alkalmazási területre) adják meg . Az engedélyezett gyógyszer jóváhagyott javallaton kívüli használatát off-label használatnak nevezik .
Az eljárás célja
Az anyagok és készítmények gyógyszerként történő engedélyezési eljárásának célja a kockázatok megelőzése és a nem biztonságos vagy hatástalan gyógyszerekből származó egészségügyi kockázatokkal szembeni védelem. Ennek része a jóváhagyási folyamat , benyújtott dokumentumok szerint a gyógyszeripari vállalat a gyógyszerkészítmény minőségét, terápiás hatékonyságát és biztonságosságát a gyógyszer , ezért ellenőrizni a kábítószer- hatóságok; a dokumentumokban szereplő információkat helyszíni szemlék ellenőrzik.
A jóváhagyás hatásai
A jóváhagyás igazolja, hogy a gyógyszer forgalomképes és forgalomba hozható, azaz például gyógyszertárakban is felkínálható. Az orvosok számára a jóváhagyás bizonyíték arra, hogy a gyógyszert pozitív kockázat / haszon arány tekintetében tesztelték a jelzett indikációban . A jóváhagyásnak azonban más hatásai is vannak.
Általában a gyógyszerjóváhagyás előfeltétele a szociális jog ellátási képességének. Sok országban léteznek más szociális jogi jóváhagyási eljárások is, amelyek függetlenek a gyógyszerek jóváhagyásától, és további előfeltételei a gyógyszerköltségek egészségbiztosító társaságok általi megtérítésének . Ezek a szabályok országonként eltérőek, gyakran kötelező árrögzítést tartalmaznak, és több hónappal késleltethetik a piacra jutást.
Ezenkívül egyes országokban speciális felelősségi előírások vonatkoznak az engedélyezett gyógyszerekre. Németországban különleges szigorú felelősség van érvényben az AMG 84. § alapján, amely szerint a gyógyszergyártó cégnek kártérítést kell fizetnie a rendeltetésszerűen használt gyógyszerek okozta károk esetén. Ez vonatkozik mind a gyártási, mind a fejlesztési hibákra. A német polgári törvénykönyv szerinti felelősséggel ellentétben a károsultnak nem kell bizonyítania az okozati összefüggést a kérelem és a keletkezett kár között. Ez a felelősség nem vonatkozik a címkén kívüli használatra. Németországgal szemben Ausztria nem vezetett be külön szigorú felelősséget a gyógyszertörvényébe.
A 469/2009/EGK rendelettel összhangban (az 1768/92 -es számú rendelet helyett) érvényes jóváhagyás szükséges az EU -ban is a kiegészítő védelmi tanúsítvány kiadásához . Egy ilyen tanúsítvány legfeljebb öt évvel meghosszabbíthatja a gyógyszerre vonatkozó szabadalom időtartamát.
Kötelezettség a felvételi eljáráson
A különböző jogrendszerekben különböző rendelkezések vonatkoznak arra, hogy a gyógyszerekre milyen engedélyköteles eljárás vonatkozik. Az Európai Unióban a 2. cikk értelmében a 2001/83 / EK irányelv rendelkezik , az ilyen gyógyszerekre a tagállamokban forgalomba hozott tagállamokban alkalmazandó európai gyógyszerjogot ipari szempontból kell előállítani és vagy elő kell készíteni, vagy ipari eljárást alkalmaznak az alkalmazás előkészítéséhez . A német gyógyszerészeti törvény határozza meg a kész gyógyszerek engedélyezési követelményét , az osztrák törvény analóg módon használja a gyógyászati specialitás kifejezést. Ez alatt olyan gyógyszereket kell érteni, amelyeket előzetesen gyártottak és ugyanazon a néven adnak a fogyasztónak vagy felhasználónak szánt csomagolásban. Svájcban az engedélyezési követelmény a használatra kész gyógyszerekre vonatkozik.
Általánosságban elmondható, hogy ez a gyógyszerek átfogó koncepcióján alapul , amely magában foglalja például a vakcinákat , számos vérkészítményt és az in vivo diagnosztikát is . A termékek lehatárolásával azonban egyes esetekben problémák merülnek fel .
A ma használatos gyógyszerek többségét az engedélyköteles gyógyszerek teszik ki. Van azonban számos kivétel, amelyek továbbra sem tartoznak az engedélyezési követelmény hatálya alá. Az Európai Unióban a homeopátiás gyógyszereket és a hagyományos növényi gyógyszereket egyszerűsített jóváhagyási eljárás (Németországban „regisztráció”) szerint lehet forgalomba hozni , feltéve, hogy megfelelnek a vonatkozó törvényi előírásoknak. Ebben az egyszerűsített eljárásban csak a minőséget és a biztonságot kell bizonyítani; A bejegyzett homeopátiás gyógyszerek esetében nem adható jelzés, a hagyományosan használt növényi gyógyszerek esetében hivatkozni kell a hagyományos felhasználásra az indikációs készítményben. Hasonlóképpen Svájc egyszerűsített jóváhagyási eljárást ír elő a kiegészítő gyógyszerek számára. A gyógyszertárakban gyártott vényköteles és védekező szerek , valamint a klinikai vizsgálatokhoz használt vizsgálati gyógyszerek nem engedélykötelesek . Bizonyos feltételek mellett a (még) nem jóváhagyott gyógyszereket a betegek rendelkezésére bocsáthatják a könyörületes használat részeként .
harmonizáció
1990 óta a Nemzetközi Harmonizációs Tanács (ICH) keretében harmonizálták a minőség, a biztonság és a hatékonyság ellenőrzéséhez szükséges alapvető kábítószer -tesztelési irányelveket, valamint a jóváhagyási dokumentumok dokumentumformátumát. Az ICH -t európai, amerikai és japán hatóságok és iparági képviselők támogatják. A harmonizáció célja az volt, hogy az egyik régióból származó nem klinikai és klinikai vizsgálatokat elismerjék a többi régióban, így azokat nem kell többször elvégezni. Az egyes hatóságok azonban függetlenek a jóváhagyási kérelmek elbírálásában, ezért gyakran előfordul, hogy bizonyos gyógyszereket nem minden régióban hagynak jóvá.
Felvételi feltételek
A legfontosabb jóváhagyási kritérium a kockázat-haszon arány mérlegelése ; Az engedélyezés csak akkor indokolt, ha a gyógyszer előnyei meghaladják a kockázatokat. Ha a gyógyszer előny-kockázat aránya a jóváhagyás után kedvezőtlenné válik, a gyógyszert ki kell vonni a forgalomból. A gyógyszer -jóváhagyást csak egy adott alkalmazási területre, egy adott jelzésre adják meg . Az engedélyezett gyógyszer jóváhagyott javallaton kívüli használatát off-label használatnak nevezik .
A jóváhagyó dokumentumok vizsgálata
A jóváhagyási folyamat fő fókusza a gyógyszergyártó által benyújtott dokumentumok felülvizsgálata, amelyeknek bizonyítaniuk kell a minőséget, a hatékonyságot és az ártalmatlanságot. A gyógyszerhatóság azt is ellenőrzi, hogy a gyógyszervizsgálat különböző fázisaiban bebizonyosodott- e, hogy a gyártást, a minőség-ellenőrzést, a nem klinikai vizsgálatokat és a klinikai vizsgálatokat (III. Fázis) az előírt gyógyszeres vizsgálati iránymutatásoknak és az ajánlott nemzetközi irányelveket, és megfelelnek a technika állásának . A Gyógyszerügyi Hatóság azonban nem szorítkozik a kérelmező által benyújtott dokumentumok vizsgálatára, hanem helyszíni ellenőrzéseket alkalmaz annak ellenőrzésére, hogy a vizsgálatokat a helyes munkamódszer (GxP) szabályai szerint végezték-e .
Szükséges jóváhagyási dokumentumok
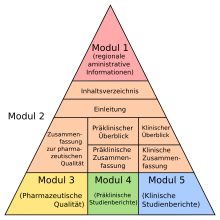
A jóváhagyási kérelemmel együtt a gyógyszeripari vállalatnak átfogó dossziét kell benyújtania a gyógyszerről meghatározott formátumban, a Common Technical Document Format (CTD) formátumban . A CTD dokumentáció öt modulban tartalmazza a szóban forgó gyógyszer gyártásának, kutatásának és fejlesztésének összes eredményét . Részletesen, a CTD 1. modul dokumentációja régióspecifikus információkat, a CTD 2. modul pedig a következő modulok áttekintését és összefoglalóit tartalmazza. A CTD 3. modul tartalmaz egy minőségi részt, amely leírja, hogyan lehet a gyógyszert megfelelő gyógyszerészeti minőségben előállítani, és hogyan kell ezt elemezni és ellenőrizni, a CTD 4. modulban pedig az előírt nem klinikai farmakológiai és toxikológiai vizsgálatokat; A CTD 5. modul a klinikai vizsgálatokból származó összes adatot tartalmazza .
A CTD formátumot az ICH -ban fejlesztették ki. A CTD bevezetésekor a cél az volt, hogy lehetővé tegyék a nagyrészt azonos dossziék benyújtását a különböző régiókban. A formátum ma már kötelező Európában, Észak -Amerikában és Japánban. Sok pályázó most elektronikus úton nyújtja be dokumentációit eCTD formájában .
A gyógyszerbiztonság folyamatos bizonyítása érdekében a gyógyszeripari vállalatoknak számos jogi követelménynek kell megfelelniük, többek között: Egy illetékes személyt kell kinevezni, kockázatkezelési tervet kell készíteni, és a felelős tisztviselők rendelkezésre állását mindenkor biztosítani kell.
Gyógyszerészeti fokozat
A gyógyszer gyógyszerészeti minősége a gyógyszer összetétele az összetevők típusa és mennyisége szerint. A német gyógyszertörvény a minőséget a gyógyszer természetének határozza meg, amelyet az azonosság, a tartalom, a tisztaság, az egyéb kémiai, fizikai, biológiai tulajdonságok vagy a gyártási folyamat határoz meg.
A jóváhagyáshoz szükséges, hogy a gyógyszer megfelelő minőségű legyen, az elismert gyógyszerészeti szabályok szerint. Ezeket a szabályokat többek között gyógyszerkönyvi monográfiák rögzítik . A benyújtandó dokumentumok nem korlátozódnak a gyógyszer összetételére. A teljes gyártási folyamatot és a nyersanyagok, csomagolóanyagok, köztes termékek és késztermékek ellenőrzését, valamint az eltarthatósági vizsgálatokat részletesen dokumentálni kell.
A gyógyszer jóváhagyása előtt a gyártónak meg kell szereznie a gyártási engedélyt. A gyártásnak a helyes gyártási gyakorlat szabályai szerint kell történnie ; ezt a hatóságok a helyszínen ellenőrzik. Szükség esetén a gyógyszerminták gyógyszerminősége vizsgálható a hivatalos gyógyszertesztelő központokban.
Amerikában a kémia, a gyártás és a vezérlés (CMC) kifejezés gyakori.
hatékonyság
A gyógyszer hatékonysága a kívánt hatások összege a tervezett alkalmazási területen. A kívánt hatások lehetnek a betegség gyógyítása, enyhítése vagy megelőzése. A jóváhagyáshoz szükséges a gyógyszer megfelelő hatékonysága a tervezett javallatban. Ez nem minden beteg sikerének garanciája, hanem annak valószínűsége, hogy a gyógyszerrel terápiás vagy megelőző eredményeket lehet elérni. Számos elfogadható módszer létezik a hatékonyság meghatározására, amelyek bizonyítékai eltérőek . Ha lehetséges, randomizált, kontrollált vizsgálatok a klinikai végpontok mint például a megbetegedések, kórházi és mortalitás kell végezni. Vannak azonban az engedélyező hatóságok által felismert okok arra, hogy a tanulmányterv és / vagy a rögzített paraméterek hatékonyságát csak kevés bizonyítékkal valószínűsítik, például járványügyi összehasonlításokkal vagy helyettesítő markerek rögzítésével . A Német Szövetségi Közigazgatási Bíróság ítélete szerint a terápiás hatékonyság kifejezés azt jelenti, hogy "a gyógyszert a gyógyulás sikere érdekében használják fel." A vizsgálatokat a helyes klinikai gyakorlat szabályai szerint kell elvégezni; a hatóságok ezt helyszíni ellenőrzésekkel ellenőrzik.
A hatékonyság bizonyításának egyik problémája az, hogy ezt gyakran olyan betegcsoportokon végzett vizsgálatokban végzik, amelyek nem egyeznek a betegekkel a mindennapi klinikai gyakorlatban, például az életkor, a nemek szerinti megoszlás és a betegség súlyossága szempontjából. Ezért a hatékonyság igazolásának mindennapos relevanciájának kérdése egyedi esetekben merül fel.
Ártalmatlanság
Az ártalmatlanság szempontjából elsősorban egy gyógyszer lehetséges ártalmasságát értékelik. Az ártalmatlanság kifejezést régóta használják a német gyógyszerészeti jogban; Nemzetközi szinten leginkább a biztonságról beszélnek. A német gyógyszertörvény szerint a gyógyszerek megkérdőjelezhetőek, ha a tudományos ismeretek jelenlegi állása szerint megalapozott a gyanú, hogy rendeltetésszerű használat esetén káros hatásuk van, amely meghaladja az orvosi ismeretek alapján indokolhatót. tudomány.
Nincs abszolút mérce annak, hogy milyen mellékhatások elfogadhatók; az aggodalmat csak a kezelendő betegség súlyosságának figyelembevételével kell értékelni. A gyógyszer ártalmatlanságának értékelésekor figyelembe kell venni annak hatékonyságát is. Az ártalmatlanság nem jelent ártalmatlanságot. Gustav Kuschinsky farmakológustól származik a mondás, miszerint azoknak a gyógyszereknek, amelyekről azt állítják, hogy nincs mellékhatásuk, nincs fő hatásuk.
A gyógyszer biztonságosságát nem klinikai és klinikai vizsgálatok során kell bizonyítani. A nem klinikai vizsgálat átfogó toxicitási meghatározást tartalmaz , amelyet megfelelő in vitro és állatkísérletekben kell elvégezni . A klinikai vizsgálatok során a résztvevők összes mellékhatását és súlyos mellékhatását gondosan dokumentálják és értékelik.
A probléma az, hogy a klinikai vizsgálatok mellékhatásait csak viszonylag kis számú beteg esetében lehet dokumentálni; Elvileg ritka és nagyon ritka mellékhatások nem azonosíthatók. Ugyanez vonatkozik a hosszú távú hatásokra is, a vizsgálatok korlátozott időtartama miatt. Ez azt jelenti, hogy a felvételkor ez csak előzetes értékelés lehet. Teljes biztonságossági profil csak széles körben elterjedt használattal és gondos alkalmazásfigyeléssel érhető el farmakovigilanciával .
Kockázat-haszon arány
A gyógyszer kockázat / haszon aránya egyrészt a kezelés hatékonysága, másrészt a gyógyszer minőségével, biztonságosságával vagy hatékonyságával kapcsolatos összes lehetséges kockázat közötti kapcsolat. Ez az arány központi jelentőségű a gyógyszer jóváhagyásáról szóló döntés szempontjából. Az előny-kockázat arány túlmutat az „ártalmatlanság” kifejezésen, mivel nem csak a betegre, hanem a közegészségre és a környezetre vonatkozó kockázatokat is figyelembe kell venni.
Ennek a kapcsolatnak nincs általánosan elfogadott szabványa; ehhez mindig egyéni döntés kell. A biztonsághoz hasonlóan a kockázat-haszon arány értékelése a jóváhagyáskor csak ideiglenes lehet. A jóváhagyási vizsgálatokból származó előny-kockázat arány általánosíthatóságának hiányát bizonyították például a nem szteroid gyulladáscsökkentők esetében .
Emiatt a kockázat-haszon arányt a jóváhagyást követően folyamatosan ellenőrizni kell a farmakovigilanciában; ha a kapcsolat kedvezőtlenné válik, a jogorvoslatot ki kell vonni a piacról. Bár az előny-kockázat arány fogalmát sok éven át használták a gyógyszerek értékelésében, csak 2004-ben vezették be az EK irányelveinek és rendeleteinek különböző cikkeibe az uniós gyógyszerjog reformjával.
A kockázatokat meghaladó hatékonyság igazolása elegendő a kábítószer -törvény szerinti jóváhagyáshoz; a többi gyógyszerrel szembeni fölény nem szükséges. A közelmúltban számos országban további értékelési eljárásokat vezettek be a gyógyszerek haszon- vagy költség-haszon értékelésére, például Németországban az Egészségügyi Minőség- és Hatékonysági Intézet (IQWiG) vagy az Egyesült Királyságban a Nemzeti Intézet az Egészségügyi és Klinikai Kiválóságért (NICE) . Ezek az értékelési eljárások nem képezik a gyógyszer -jóváhagyás részét. Ezeket az egészségbiztosító társaságok által a gyógyszerek visszatérítésének értékelésére használják .
A készítmény alkalmazási előírása

A jóváhagyási folyamat során a gyógyszerre vonatkozó lényeges információkat, amelyeket tanulmányi eredmények igazoltak, és a kérelmező és a jóváhagyó hatóság közötti megfogalmazásban állapodtak meg, a termékjellemzők összefoglalják . Ez a fontos dokumentum minden lényeges információt tartalmaz, például a javallatokat, ellenjavallatokat , adagolást , kölcsönhatásokat és mellékhatásokat, beleértve az értékelést és a mérlegelést. Ez az összefoglaló jóváhagyás után is csak a hatóság jóváhagyásával módosítható.
Felvételi folyamat
A jóváhagyási eljárásokat nemzeti szabályozások és nemzetközi megállapodások szabályozzák. Ezenkívül a jóváhagyás alapjául szolgáló orvosi hátteret folyamatosan fejlesztik a konszenzuson alapuló orvoslástól a bizonyítékokon alapuló orvoslásig .
Európai Únió
Az európai belső piac megvalósítása során 1995 -ben szabványosított eljárásokat vezettek be az EU jóváhagyására, így nem kell minden uniós országban leküzdeni a különböző bürokratikus akadályokat. Erre a célra a jogi keretet a 2001/83 irányelv / EK létrehozására közösségi kód emberi felhasználásra szánt gyógyszerekre és az irányelv 2001/82 / EK létrehozására közösségi kódot állatgyógyászati készítmények (a helyébe rendelet ( EU) 2019/6 az állatgyógyászati készítményekről 2022 -től ) az EU -szerte harmonizált jelenlegi változatban. Különféle uniós jóváhagyási eljárásokat dolgoztak ki, amelyek közül néhány a decentralizált intézmények koordinációján és néhány a központosításon alapul. Mindenesetre a nemzeti hatóságoknak továbbra is kulcsszerepük van.
Központosított eljárás
Az innovatív gyógyszerek fő eljárása a 726/2004/EK rendeleten alapuló központosított eljárás . Ez az eljárás számos gyógyszer esetében kötelező. Ide tartoznak a fejlett terápiás szerek és a monoklonális antitestek, valamint az új hatóanyagú humán gyógyszerek az AIDS , a cukorbetegség , a rák , a neurodegeneratív betegségek , az autoimmun betegségek és más immunhiányok és vírusos betegségek kezelésére . Szintén árva gyógyszerek kezelésére ritka betegségek és az állatgyógyászati készítmények a teljesítmény javítása érdekében esnek szükségszerűen az eljárás alá. Az eljáráshoz való hozzáférés számos más gyógyszer esetében opcionális.
A központosított eljárásban a tudományos értékelést és a jóváhagyási határozatot intézményesen elválasztják egymástól. A jóváhagyási kérelmet az Európai Gyógyszerügynökséghez (EMA) kell benyújtani. Az engedély iránti kérelem elbírálási eljárását az Európai Gyógyszerügynökség tudományos bizottságai - az emberi felhasználásra szánt gyógyszerek esetében az emberi felhasználásra szánt gyógyszerek bizottsága - végzik ; A nemzeti gyógyszerészeti hatóságok magas rangú képviselőit a tagállamok küldik meg ezekbe a bizottságokba. Az Ügynökség felelős tudományos bizottságából kiválasztott előadó és a társelőadó a nemzeti gyógyszerhatóságok szakértőivel együtt értékelő jelentést készít a gyógyszerről, amelyet az Európai Gyógyszerügynökség felelős tudományos bizottsága 210 napon belül elfogad. legkésőbb nap. E jelentés alapján az Európai Bizottság a tagállamokkal az állandó bizottságban folytatott konzultációt követően 67 napon belül jóváhagyja az egész Európai Uniót . A nemzeti és európai intézmények ezért szorosan együttműködnek a központosított eljárásban. A megadott uniós jóváhagyást rendszeresen elfogadják az Európai Gazdasági Térségben (EGT).
A fogyasztó az engedélyszám segítségével láthatja, hogy egy gyógyszert központilag engedélyeztek -e; a szám ezután az "EU" azonosítóval kezdődik. Például a Humira egyik jóváhagyási száma az EU/1/ 03 / 256 / 007 . A második számjegy azt jelzi, hogy állatgyógyászati vagy humán gyógyszer (1 = ember, 2 = állatgyógyászati). A harmadik számjegy az első jóváhagyás évét jelzi, itt 2003.
1995 -től 2007 szeptemberéig körülbelül 400 emberi és 75 állatgyógyászati készítményt engedélyeztek a központosított eljárás keretében. Minden újonnan engedélyezett gyógyszerről részletes európai nyilvános értékelő jelentést (EPAR) tesznek közzé.
Decentralizált eljárások (MRP és DCP)
A kölcsönös elismerési eljárás (MRP) és a hasonló decentralizált eljárás (DCP) során a jóváhagyási kérelmet egy tagállam (referencia -tagállam) hatósága vizsgálja meg, és értékelő jelentést készít. A többi érintett tagállam hatóságai ezt az összehangolt folyamat során elismerik. A kérelmező kiválaszthatja, hogy az EU és az EGT mely tagállamaira kíván engedélyt kérni.
A kölcsönös elismerési eljárás során a nemzeti engedélyt először a kiválasztott országban kérik és adják meg, mielőtt a többi országban azonos kérelmeket nyújtanak be, és megkezdik az elismerési eljárást. A 2005 -ben bevezetett decentralizált eljárásban nem lehet nemzeti jóváhagyás az EU -ban; Itt azonos kérelmeket nyújtanak be egyszerre minden államban, és egy államot választanak ki referencia -tagállamnak.
Ha az egyes tagállamok elutasítják a referencia -tagállam értékelését a közegészségre gyakorolt súlyos kockázat miatt, minden részt vevő államnak egy koordinációs csoportban kell törekednie arra, hogy megállapodásra jussanak a meghozandó intézkedésekről. Ha a koordinációs csoport hatóságai nem tudnak megegyezni, választottbírósági eljárás indul az Európai Gyógyszerügynökség tudományos bizottságában. A Tudományos Bizottság értékelése alapján az Európai Bizottság végleges döntést hoz a választottbírósági eljárásban, miután konzultált a tagállamokkal az Állandó Bizottságban.
A nem központosított eljárásokban az engedélyt mindig a nemzeti hatóságok adják meg.
Évente több száz nem központosított eljárást hajtanak végre; ezek nagy része generikus .
Nemzeti eljárások
1995 -ig a nemzeti eljárások voltak az egyetlen módja annak, hogy egy gyógyszert jóváhagyjanak az EU -ban. Ezek a nemzeti eljárások az európai eljárások következtében sokat veszítettek jelentőségükből. Azonban sok olyan gyógyszer van a piacon, amelyeket ilyen eljárásokkal engedélyeztek. Ma a tisztán nemzeti jóváhagyás csak egy tagállamban lehetséges; több tagállamban a nemzeti jóváhagyási kérelmek már nem fogadhatók el. Ma egy ilyen nemzeti jóváhagyás általában a kölcsönös elismerési eljárás kiindulópontja. Németországban a Szövetségi Kábítószer- és Orvosi Eszközök Intézete (BfArM) a "normál" gyógyszerekre, a Paul Ehrlich Intézet a vérkészítményekre és oltásokra , a Friedrich Loeffler Intézet az egzotikus állatbetegségek elleni immunológiai állatgyógyászati készítményekre, valamint a Szövetségi Fogyasztóvédelmi és Élelmiszerbiztonsági az állatgyógyszerek felelős. Ausztriában olyan gyógyszer van az osztrák és Egészségvédelmi Ügynökség Élelmiszerbiztonsági terület Medicine Piacfelügyeleti Hatóság (korábban AGES PharmMed) engedélyezett és felügyelt.
Svájc
Mivel Svájc nem tagja sem az Európai Uniónak, sem az Európai Gazdasági Térségnek, Svájc önállóan hajt végre minden gyógyszer -jóváhagyást; Elvileg azonban figyelembe lehet venni a hasonló drogellenőrzéssel rendelkező országok jóváhagyásait. A jogalap a terápiás termékekről szóló törvény , amely szabályozza a gyógyszereket és az orvosi eszközöket. A jóváhagyás részletei megtalálhatók a gyógyszer -jóváhagyási rendeletben. Az engedélyezésért és a gyógyszerek ellenőrzéséért felelős szerv a Swissmedic . Az engedélyezési kérelmek belső feldolgozási ideje 200 nap, a gyorsított eljárásban benyújtott kérelmek esetében 130 nap. Van egy egyszerűsített jóváhagyási eljárás bizonyos gyógyszerekre, beleértve az ismert hatóanyagokat tartalmazó gyógyszereket, a kiegészítő gyógyászatból származó gyógyszereket, a kórházi készítményeket és a ritka vagy életveszélyes betegségek gyógyszereit.
Egyesült Államok
Az USA -ban a gyógyszerek jóváhagyása olyan folyamat, amely sokkal korábban kezdődik, mint Európában.
Elvileg az USA -ban a folyamat az első klinikai vizsgálat (Investigational New Drug application, IND) jóváhagyási kérelmével kezdődik . Ott nemcsak kivonatok, hanem teljes tanulmányi jelentések is benyújtásra kerülnek, ellentétben az európai klinikai vizsgálatok engedélyezési folyamatával, amelyeket ezután folyamatosan lehet hozzáadni gördülő beadványban a klinikai fejlesztés során (folyamatos benyújtás) . Ebben az esetben sok dokumentumot már elbíráltak a tényleges jóváhagyási kérelemhez, az új gyógyszerkérelemhez , az NDA -hoz . Miután az Élelmiszer- és Gyógyszerügyi Hatóság (FDA) az NDA -t teljesnek és a formai követelményeknek megfelelően elfogadta , az FDA meghatározott időn belül felülvizsgálja a kérelmet. Meghallgatása után a bizottság a szakértők és a gyógyszeripari cég, az FDA úgy dönt, hogy a gyógyszer nem kerül jóváhagyásra, hogy a kérelem jóváhagyható , ami azt jelenti, hogy az FDA vállalja, hogy hagyja jóvá a gyógyszer bizonyos feltételek mellett meg kell felelniük a kérelmező, illetve hogy a A kérelmet elutasítják (nem elfogadható) .
A humán klinikai vizsgálatokat megkezdő gyógyszerfejlesztések mindössze 10% -a kapja meg az FDA jóváhagyását.
Bizonyos körülmények között, megfelelően Animal Hatásossági szabály, igazolása hatásosság állatkísérletekben elegendő .
A jóváhagyási döntések nemzetközi elismerése
Még akkor is, ha számos országban harmonizálták a gyógyszerek jóváhagyásának számos kritériumát, és a gyógyszergyárak gyakran gyakorlatilag azonos dokumentumokat nyújtanak be, a hatóságok egyedi esetekben ellentétes döntésekre jutnak. Ez annak a ténynek köszönhető, hogy a hatóságok nagy mozgásteret kapnak a jóváhagyás tekintetében, és hogy a gyógyszerrel kapcsolatos lényeges állítások valószínűségi állításokon alapulnak.
Az Európai Unióban három évtizedbe telt, amíg a nemzeti hatóságok kialakították a kellő kölcsönös megértést ahhoz, hogy az EU jóváhagyási folyamata sikeres legyen.
Az európai hatóságok egyrészt, másrészt az FDA messze vannak ettől a ponttól. Például egy rimonabantot tartalmazó gyógyszert 2006 -ban hagytak jóvá az Európai Unióban , míg az FDA 2007 -ben biztonsági okokból elutasította ugyanazon gyógyszerre vonatkozó engedélykérelmet. Ezzel szemben a Mylotarg rákellenes gyógyszert gemtuzumab-ozogamicin monoklonális antitesttel már 2000 - ben jóváhagyták az USA-ban, míg az EU-ban 2008-ban elutasították a jóváhagyási kérelmet.
Ennek megfelelően a kábítószer -jóváhagyások nemzetközi kölcsönös elismerésére irányuló különböző erőfeszítések eddig csak részleges sikerhez vezettek. Az Európai Unió, Ausztrália, Japán, Kanada, Új -Zéland, Svájc és az USA között kölcsönös elismerési megállapodásokat kötöttek a helyes gyártási gyakorlat ellenőrzésének kölcsönös elismerésére vonatkozóan. Az USA -val kötött megállapodást még nem hajtották végre, Japánnal csak részben.
Különleges eljárások és kategóriák
Speciális útvonalak a gyorsabb elérés érdekében
A gyógyszerek kifejlesztése és jóváhagyása hosszú, többéves folyamat. Annak érdekében, hogy ne késleltessük szükségtelenül az innovatív, esetleg életmentő gyógyszerekhez való hozzáférést, különleges eljárásokat vezettek be az Európai Unióban és az Egyesült Államokban, amelyek kivételes esetekben felgyorsítják a jóváhagyást.
A központosított uniós eljárás gyorsított értékelési eljárása és az FDA elsőbbségi felülvizsgálati eljárása jelentősen lerövidítette a feldolgozási időt a szokásos eljárásokhoz képest. Ez több hónappal felgyorsíthatja a jóváhagyást; Az EU -ban a tudományos bizottságban a feldolgozási idő 210 -ről 150 napra csökken. A hatóságok eseti alapon ellenőrzik, hogy egy kérelmet feldolgoznak-e ebben a folyamatban. Csak az Egyesült Államokban 2006 -ig évente körülbelül 10-15 gyógyszert dolgoztak fel és hagytak jóvá a prioritási felülvizsgálat során ; az EU -ban az ekulizumab volt az első olyan gyógyszer, amelyet 2007 nyarán engedélyeztek a gyorsított folyamatban.
Az 507 /2006 / EK rendelet alapján az EU központosított eljárásának feltételes jóváhagyása (feltételes forgalomba hozatali engedélye) lehetővé teszi, hogy az egyedi eset, különösen életveszélyes betegségek esetén, hozzon gyógyszert, mielőtt befejezi a teljes klinikai vizsgálatot a piacon. Ebben az esetben a gyógyszeripari vállalat vállalja, hogy egy bizonyos időn belül teljesíti a hatóság által meghatározott feltételeket, például teljes körű III. a feltételes jóváhagyás egy évig érvényes, de a hatóság általi értékelés után évente meghosszabbítható a rendszeres jóváhagyás megadásáig. A sürgősségi engedélyekkel szemben feltételes engedély esetén az engedély jogosultja általában teljes mértékben felelős a gyógyszerért és annak biztonságáért. Ez az eljárás is csak eseti vizsgálat után lehetséges. Az első feltételes jóváhagyású gyógyszer az EU -ban a Sutent (hatóanyag: szunitinib ) volt 2006 nyarán . Egy tanulmány szerint a 2006 és 2015 közötti időszakban az EU -ban feltételes jóváhagyással rendelkező gyógyszerek esetében a követelmények teljesítésének átlagos ideje négy év volt; az eljárások több mint egyharmadában késések vagy következetlenségek voltak ezzel kapcsolatban. A szerzők arra a következtetésre jutnak, hogy a feltételes jóváhagyás lehetővé teszi azokhoz a gyógyszerekhez való hozzáférést, amelyek klinikai értékét hosszú időn keresztül nem sikerült teljes mértékben megállapítani, és ezzel együtt járhatnak a betegekre vonatkozó kockázatok.
Az USA -ban a gyorsított jóváhagyás hasonlóságot mutat az EU -ban feltételes jóváhagyással; Itt is ideiglenes jóváhagyást adnak, azzal a feltétellel, hogy olyan klinikai vizsgálatokat kell végezni és befejezni, amelyekben a betegek előnyei klinikailag releváns végpontok alapján bizonyítottak. A gyorsított jóváhagyás elsősorban a helyettesítő jelzőkön alapul a döntés meghozatalakor . A probléma az, hogy az Egyesült Államokban a vállalatok gyakran nem teljesítik a klinikai vizsgálatok jóváhagyás után történő elvégzésének követelményeit.
A jóváhagyás kivételes esetekben (kivételes körülmények) az EU-ban centralizált eljárás jöhet szóba, ha talán nem teljes körű adatok tehetők a hatékonysága és biztonságossága rendelkezésre a gyógyszer a jövőben, talán azért, mert az érzékelés nem etikátlan lehetséges vagy vagy a kezelendő betegség nagyon ritka. A feltételeket évente újraértékelik.
A PRIME (kiemelt gyógyszerek) alkalmazásával az EMA 2016 óta kínál olyan eljárást a gyógyszergyártóknak, amely mindig választható, ha egy területen hiány van („ kielégítetlen orvosi szükséglet” ) , azaz ha nincs hatékony terápia. vagy az új szer terápiás előnyt kínál. Különösen a kisvállalatokat vagy egyetemi intézményeket kell támogatni folyamatos szabályozási és tudományos tanácsadással a fejlesztés korai szakaszában. A PRIME programban eddig több mint 60 gyógyszer szerepelt (2020 -tól).
Az adaptív utak koncepciója (németül „testreszabható módszerekről”; más néven gyógyszerek alkalmazkodó útvonalai a betegek számára , MAPP) az EMA erőfeszítéseinek része, hogy a meglévő jogi kereteken belüli betegek rugalmassága révén gyorsabb hozzáférést biztosítsanak az új gyógyszerekhez. Az adaptív útvonal koncepciója három elven alapul: Először is, iteratív fejlesztés - ez vagy fokozatos jóváhagyást jelent, kezdve a korlátozott betegpopulációval, amely kiterjeszthető nagyobb populációra, vagy a kiegyensúlyozott kockázat -haszon arány megerősítését. a korai adatokon a helyettesítő markerekkel, amelyeket a legfontosabb klinikai eredmények előrejelzőjeként tanulmányoztak; másodszor, az egészségügyi adatokra vonatkozó bizonyítékok gyűjtéséről („valós életben történő felhasználás”) a klinikai vizsgálatokból származó adatok kiegészítése érdekében; harmadszor, a betegek és a felülvizsgálati panelek korai bevonása a gyógyszerfejlesztésről szóló vitába. A BfArM és az EMA egy kísérleti projektben tesztelte az adaptív útvonal megközelítését 2014 és 2016 között. A kritikusok attól tartanak, hogy a jóváhagyási szabványokat a hatékonyság és az ártalmatlanság szigorúan szabályozott jóváhagyási szempontjainak rovására kell csökkenteni. Az adaptív utakat kezdetben csak bizonyos gyógyszerek esetében szabad használni, például ha sürgős szükség van a kezelési alternatívák hiánya miatt (kielégítetlen orvosi szükséglet) . A projekt nyomon követése magában foglalja az együttműködést az egészségügyi technológia értékelő testületeivel és további érdekelt felekkel, például a betegekkel és a fizetőkkel.
Vészhelyzeti eljárás
A gördülő felülvizsgálati folyamat ("folyamatos felülvizsgálat" = "folyamatos felülvizsgálat") az egyik szabályozási eszköz, amely az Európai Gyógyszerügynökség (EMA) rendelkezésére áll a központosított jóváhagyási folyamatban egy ígéretes vizsgálati gyógyszer kiértékelésére vészhelyzetben a közegészségügy területén - például B. világjárvány - felgyorsítása. Az előadóket már kinevezik, amíg a fejlesztés folyamatban van, és az EMA folyamatosan felülvizsgálja az adatokat, amint elérhetővé válnak.
A járványhelyzetekben alkalmazandó influenza elleni védőoltások (influenza elleni védőoltások) esetében speciális eljárásokat is alkalmaznak a rendelkezésre állás felgyorsítására. Ez magában foglalja az EU-t, a mintaoltási módszert (maketteljárást) , egy már jóváhagyott vakcinamodellt alkalmazva az aktuális járványtörzshez igazítják, miután azonosították. Egy másik eljárás a " sürgősségi eljárás" . Lehetővé teszi egy új influenza elleni vakcina gyors jóváhagyását, ha azt egy járványjelentés eredményeként fejlesztik ki. Mindkét eljárás esetében a tudományos bizottság általi értékelés időtartama a szokásos 210 nap helyett 70. A harmadik eljárás a szezonális influenza elleni, már jóváhagyott vakcinákból származó vakcinák jóváhagyására vonatkozik . Ezeket azonban úgy módosították, hogy felhasználhatók legyenek az influenzajárvány elleni védekezésre . Ezt az eljárást általában országosan gyakorolják, mivel a legtöbb szezonális influenza elleni védőoltás országosan jóváhagyott.
Az USA -ban lehetőség van a gyógyszerek vészhelyzeti felhasználási engedélyének (EUA) kiadására . Az Élelmiszer- és Gyógyszerügyi Hatóság által kiadott „orvosi ellenintézkedések” ( orvosi ellenintézkedések , MCM) vészhelyzeti felhasználási engedélyét akkor mondják ki (FDA), ha a közegészségügy területén vészhelyzetet állapítottak meg, például CBRN esetén - Bedrohung vagy járvány. A jogalap a szövetségi élelmiszer-, gyógyszer- és kozmetikai törvény (FD&C Act).
Ritka gyógyszerek
Az ritka betegségek gyógyszerei ritka betegségek kezelésére, megelőzésére vagy diagnosztizálására szolgálnak . Az ilyen értelemben vett ritka betegségek 10 000 -ből kevesebb mint 5 embert érintnek az EU -ban. Az EU -ban a ritka betegségek gyógyszereit központosított eljárásban kell engedélyezni; A ritka betegségek gyógyszere státuszt az Európai Bizottság ítéli oda az Európai Gyógyszerügynökség Ritka Betegségek Gyógyszereinek Bizottsága (COMP) ajánlása alapján. Ezt 2007 szeptemberéig 500 gyógyszerre tették; Ezek közül eddig 36 -ot hagytak jóvá. A ritka betegségek gyógyszerei esetében a gyógyszeripari vállalatok támogatást kapnak az Európai Gyógyszerügynökségtől a szükséges vizsgálatok megtervezésében, valamint kedvezményeket kapnak a jóváhagyási és vizsgálati díjakból, valamint a tízéves piaci kizárólagosságot.
Generikus gyógyszerek
A generikus gyógyszerek lényegében azonos gyógyszerek, amelyek ugyanazt a gyógyszert tartalmazzák ugyanabban a dózisban és adagolási formában, mint a referencia -gyógyszer , amely már nem szabadalmaztatott. Ezekre a gyógyszerekre egyszerűsített engedélyezési feltételek vonatkoznak. E célból dokumentálni kell a gyártást és a gyógyszerészeti minőséget, valamint dokumentálni kell az eredeti gyógyszer biohasznosulását és biológiai egyenértékűségét . A többi nem klinikai és klinikai adat tekintetében a kérelmező hivatkozhat a referencia-gyógyszerre vonatkozó adatokra. Az EU -ban azonban a szabadalmi oltalomtól függetlenül ez csak nyolc évvel lehetséges a referencia -gyógyszer jóváhagyása után; maga a jóváhagyás csak tíz évvel az eredeti jóváhagyás megadása után adható meg. A bioszimilárisokra különleges feltételek vonatkoznak.
A már ismert hatóanyagokat tartalmazó gyógyszerek esetében létezik egy másik alkalmazástípus is, amely egyszerűsített jóváhagyási feltételekkel rendelkezik az "általános orvosi felhasználáson" túl (jól bevált felhasználás) : A kérelmezőnek nem kell benyújtania saját preklinikai és klinikai vizsgálatainak adatait, ha bizonyítani tudja, hogy a gyógyszer hatóanyagait legalább tíz éve használják általános orvosi célokra az EU -ban. Más releváns tudományos dokumentáció, amelyből a már ismert hatások és mellékhatások láthatók, majd felváltja a saját tanulmányokat. Például az ismert növényi hatóanyagokat tartalmazó gyógyszerek esetében a Növényi Gyógyászati Készítmények Bizottsága által készített monográfiák használhatók.
Eljárás a jóváhagyás után
Az engedély megadása kulcsfontosságú lépés, de ez semmiképpen nem zárja le a szabályozási tevékenységeket. A regisztrációs dokumentumokat folyamatosan frissíteni kell, és a gyógyszer használatát folyamatosan ellenőrizni kell. Új gyógyszerek esetében az engedélyt csak korlátozott ideig, általában öt évre adják meg. Ezen időtartam lejárta előtt a jóváhagyást meg kell újítani, általában ez azután határozatlan ideig érvényes. Ha azonban egy jóváhagyott gyógyszert meghatározott időn belül nem hoznak forgalomba, vagy ha hosszabb ideig nincs forgalomban, a jóváhagyás általában lejár ( "megszüntetési záradék" ). Az EU -országok esetében ez a határidő vagy időszak három év.
Az értesítések módosítása
A gyógyszeripari vállalat köteles értesíteni az illetékes hatóságokat minden olyan változásról, amely befolyásolja a jóváhagyást. Attól függően, hogy milyen mértékben hajtják végre a változtatásokat, néhányat a hatóságoknak jóvá kell hagyniuk. Az egyszerű, csak bejelentést igénylő változtatások például adminisztratív változtatások a gyártónál vagy kisebb változtatások a gyártási folyamatban. Például az adag , az adagolási forma vagy a jelentkezési lap módosítása jóváhagyást igényel . A termékjellemző bármilyen módosítása szintén jóváhagyást igényel.
Ha egy gyógyszer jóváhagyását további indikációra kell kiterjeszteni, ehhez külön, teljes jóváhagyási kérelem szükséges.
Farmakovigilancia
A gyógyszergyártó cég a jóváhagyás után is köteles összegyűjteni és értékelni a káros mellékhatásokra vonatkozó megállapításokat. Erről a felügyeleti hatóságot meghatározott időközönként, súlyos, váratlan mellékhatások esetén pedig rövid időn belül jelenteni kell. A folyamatos ellenőrzés azért fontos, mert a csak néhány ezer beteget érintő klinikai vizsgálatok során nem lehet ritka vagy nagyon ritka mellékhatásokat észlelni. A nagyon későn jelentkező mellékhatásokat szintén nehéz rögzíteni a jóváhagyási tanulmányokban.
Az új megállapítások az engedély korlátozásához vezethetnek, például a termékjellemzők megváltoztatásával. Ha egy gyógyszer alkalmazása során olyan súlyos mellékhatásokról van szó , amelyek a kockázat / haszon arányt kedvezőtlenné teszik, a jóváhagyás is teljesen visszavonható. Az USA -ban 1975 és 1999 között jóváhagyott új hatóanyagú gyógyszerek 2,9% -át kivonták a forgalomból hiányosságok miatt. Az Egyesült Királyságban 1972 és 1994 között 3,8% volt. A piacról való kivonás fő oka az elfogadhatatlan mellékhatások. Bizonyos esetekben, például a klobutinol esetében , a jóváhagyást csak a biztonsággal kapcsolatos aggályok miatt vonták vissza, miután a gyógyszert évtizedek óta használták.
A farmakovigilancia területén is a gyógyszerügyi hatóságok ellenőrzést végeznek a gyógyszeripari vállalatoknál annak ellenőrzése érdekében, hogy az előírt ellenőrző intézkedéseket megfelelően hajtják -e végre.
A gyógyszerek jóváhagyásának története
Az engedélyezési eljárásokat világszerte vezették be, miután a gyógyszerkészítményt a gyógyszertárakban nagyrészt ipari termelés váltotta fel, és a különböző gyógyszerbotrányok megrendítették a gyógyszerek biztonságába vetett bizalmat.
A 20. század eleje óta a gyógyszeripar ipari előállítása nagyrészt felváltotta a gyógyszertári készítményt. Néhány országban azonban már a huszadik század első felében volt forgalomba hozatali engedélyezési eljárás a kábítószerekre, köztük Franciaország, Svédország, Norvégia és különösen az Egyesült Államok. Az Egyesült Államokban az 1938 -as szövetségi élelmiszer-, gyógyszer- és kozmetikai törvény kötelezővé tette az új gyógyszerek jóváhagyását ; ezt a törvényt a kongresszus fogadta el a szulfanilamid katasztrófa után . Ekkor azonban a jóváhagyási kritériumok a gyógyszer minőségére és biztonságára korlátozódtak; Ekkor egy gyógyszert akkor tekintettek jóváhagyottnak, ha az illetékes hatóság, az Élelmiszer- és Gyógyszerügyi Hatóság (FDA) egy bizonyos időn belül nem tiltakozott.
A hatékonysági kritériumot és a jelenlegi jóváhagyási eljárást csak 1962-ben vezette be az Egyesült Államokban a Kefauver-Harris Drug Módosítás , amelyet a talidomid- botrány leleplezésével egy időben vitattak meg. Az akkori események tartós hatással voltak a jogalkotási folyamatra; A Kongresszus eredeti jogalkotási folyamata a túlzott gyógyszerárak és a tisztességtelen gyógyszerreklám ellen fogyasztóvédelmi törvény lett. Az USA -ban akkor kidolgozott korlátozó felvételi kritériumokat sok más ország is elfogadta a következő években. A nyolcvanas évek végén és a kilencvenes évek elején gyorsított jóváhagyási eljárásokat vezettek be az Egyesült Államokban, válaszul arra, hogy sürgősen szükség van az AIDS kezelésére szolgáló gyógyszerekre .
Azért is, mert a thalidomid botrány volt az Európai Gazdasági Közösség , az irányelv / / EGK 65. 65. A Tanács 1965. január 26-közelítéséről szóló törvényi, rendeleti és közigazgatási rendelkezések közelítéséről gyógyszerek engedélyezett. Ez először engedélyt biztosított a gyógyszerek forgalomba hozatalához, és megkövetelte a terápiás hatékonyság igazolását. Az alábbi 1975 -ös 75 /319 / EGK irányelv sokkal részletesebb volt a jóváhagyási követelményekben. Ezenkívül egy új európai szakértői testületet hoztak létre az irányelvvel, amely létrehozta a szabadalmazott gyógyszerek bizottságát (angolul a szabadalmaztatott gyógyszerek bizottságát, CPMP ), a mai emberi felhasználási bizottság (CHMP) elődjét. 1987 -ben a 87 /22 / EGK irányelv meghatározta az egyeztetési eljárást az innovatív gyógyszerekre, a mai központosított eljárás előfutára, amelyet 1993 -ban határoztak meg a 2309/93 / EGK irányelvvel, és 1995 -től hajtottak végre. A közösségi eljárásokat csak az 1995 -ben hatályba lépett reformok széles körben alkalmazták. A jelenlegi keretet ezután az európai gyógyszerészeti jogszabályok 2001 és 2004 közötti felülvizsgálata során hozták létre.
A Német Szövetségi Köztársaságban az első EGK -irányelv 1965 -től a nemzeti jogba történő átültetése hosszú folyamat volt, amely csak az 1976 -os második kábítószer -törvény hatálybalépésével zárult le . Nem volt egészen 1975-ig, hogy egy intézet kábítószer kábítószer-jóváhagyási ben alakult az akkori Szövetségi Egészségügyi Hivatal , miután a Szövetségi Egészségügyi Hivatal feloldjuk 1994 eredményeképpen a vér-AIDS-botrány, ez lett a mai Szövetségi Intézet Kábítószer és orvosi eszközök . Az új jogi eszközöknek a régi gyógyszerekre való alkalmazása az engedélyezési eljárásban 2005 végéig tartott Németországban.
irodalom
- Martin Lorenz: A közösségi kábítószer -jóváhagyási törvény, különös tekintettel a 2004/2005 -ös reformra. Nomos-Verlags-Gesellschaft, Baden-Baden 2006, ISBN 3-8329-1912-0 .
web Linkek
- EudraLex - 2. kötet - Gyógyszerészeti jogszabályok a kérelmezők értesítéséről és az emberi felhasználásra szánt gyógyszerekre vonatkozó szabályozási irányelvek
- Európai Gyógyszerügynökség
- Szövetségi Kábítószer- és Orvosi Eszközök Intézete (BfArM)
- A jóváhagyott gyógyszerek adatbázisa a BfArM -en
- Paul Ehrlich Intézet
- Osztrák Egészség- és Élelmiszerbiztonsági Ügynökség
- Swissmedic (Svájci Terápiás Termékek Ügynöksége)
- Gyógyszerek az Európai Unióban (PDF)
Egyéni bizonyíték
- ↑ Elizabeth Storz: Kábítószer -biztonság . In: GIT Labor-Fachzeitschrift. 2008. augusztus, 712-714.
- ↑ 4. szakasz (15) AMG.
- ^ Kémiagyártás és vezérlés (CMC). Irányelvek az ipar számára (GFI -k). Letöltve: 2021. március 16 .
- ↑ Karl Feiden , Hermann Pabel: Gyógyszerészeti szótár. 3. kötet: Gyógyszer- és gyógyszerészeti jog. Tudományos kiadóvállalat, Stuttgart 1985, ISBN 3-8047-0670-3 .
- ↑ A 2001 /83 / EK irányelv I. mellékletének I. része, 5.2.5.1.
- ↑ Robert Kemp és Vinay Prasad: Helyettesítő végpontok az onkológiában: mikor elfogadhatók szabályozási és klinikai döntésekhez, és jelenleg túlzottan használják? , BMC Medicine 15. kötet, 134. cikk (2017), hozzáférés: 2019. október 30.
- ↑ STIKO: Az oltások járványügyi és egészségügyi gazdasági hatásainak előrejelzésére szolgáló modellezés végrehajtásának és mérlegelésének módszerei az Állandó Oltási Bizottság számára , 2016. március 16., hozzáférés: 2019. október 30.
- ↑ FDA: A gyógyszerek jóváhagyásának vagy engedélyezésének alapjául szolgáló helyettesítő végpontok táblázata , online, 2019. szeptember 30, hozzáférés: 2019. október 30.
- ↑ BVerwG E 84. kötet, 215-224. O., 1993. október 14-i ítélet Az. 3 C 21.91.
- ↑ 5. § AMG.
- ↑ Dieter Hart: Az előny / kockázat értékelés a gyógyszerjogban. Az egészségtechnológiai értékelés egyik eleme. In: Szövetségi Egészségügyi Közlöny . 48. kötet, 204-14 (2005), PMID 15726462 . doi: 10.1007 / s00103-004-0977-2
- ^ P. Dieppe, C. Bartlett, P. Davey, L. Doyal, S. Ebrahim: Kiegyensúlyozó előnyök és károk: a nem szteroid gyulladáscsökkentők példája. In: BMJ . 329. kötet (7456), 2004, 31-34 . O. , PMID 15231619 .
- ↑ A Paul Ehrlich Intézet Tudományos Tanácsadó Testülete: Jegyzőkönyv a 2017. május 30 -i alakuló ülésről ( PDF ).
- ↑ Központosított eljárás a Szövetségi Kábítószer- és Orvosi Eszközök Intézetének honlapján, hozzáférhető 2020. június 10 -én.
- ↑ 2A. Kötet - Forgalomba hozatali engedélyezési eljárások, 2. fejezet - Kölcsönös elismerés. ( PDF ) In: EudraLex - 2. kötet - A kérelmezők értesítésére vonatkozó gyógyszerészeti jogszabályok és az emberi felhasználásra szánt gyógyszerek szabályozási irányelvei .
- ↑ Statisztikák a nem központosított jóváhagyási folyamatokról a gyógyszerügynökségek vezetőinél .
- ↑ Információ a gyógyszeripari vállalatok számára , az FDA honlapján.
- ↑ Vélemény | Megoldás a gyógyszerárakra . 2015. szeptember 9. ( nytimes.com [letöltve: 2018. október 29.]).
- ↑ Nemzetközi együttműködés a gyógyszeriparban - Kulcsdokumentumok , EU Bizottság. Letöltve: 2020. június 10.
- ↑ Gyorsított értékelés az EMA szószedetében, hozzáférhető 2020. június 10 -én.
- ↑ NME Drug and New Biologic Approvals in 2006 , FDA Document Archive, hozzáférve 2020. június 10 -én.
- ↑ New Molecular Entity (NME) Drug and New Biologic Approvals , FDA weboldal, 2020. június 10.
- ↑ Az EMEA befejezte az emberi felhasználásra szánt gyógyszer első gyorsított értékelését , az EMA 2007. április 27 -i sajtóközleményét ( PDF ).
- ↑ Feltételes forgalomba hozatali engedély az EMA szószedetében, hozzáférhető 2020. június 10 -én.
- ↑ Kérdések és válaszok: A COVID-19 vakcinák feltételes forgalomba hozatali engedélye az EU-ban. Európai Bizottság, 2020. december 11., hozzáférés 2021. augusztus 20 -ig .
- ↑ Kérdések és válaszok: Feltételes forgalomba hozatali engedély a COVID-19 vakcinákra az EU-ban. Európai Bizottság, 2020. december 11., hozzáférés 2021. augusztus 20 -ig .
- ^ R. Banzi, C. Gerardi, V. Bertele, S. Garattini: A bizonytalan előny-kockázat profilú gyógyszerek jóváhagyása Európában . In: European Journal of Internal Medicine . szalag 26. , 2015. o. 572-584 , doi : 10.1016 / j.ejim.2015.08.008 .
- ^ CD Furberg, AA Levin, PA Gross, RS Shapiro, BL Strom: Az FDA és a gyógyszerbiztonság: javaslat az elsöprő változtatásokra. In: Arch Intern Med . 166. kötet (18), 2006, 1938-1942, PMID 17030825 .
- ↑ Kivételes körülmények az EMA szószedetében, hozzáférhető 2020. június 10 -én.
- ↑ Európai Gyógyszerügynökség : PRIME: kiemelt gyógyszerek. Letöltve: 2020. június 12 .
- ↑ a b EMA: Adaptív útvonalak : „Az adaptív utak megközelítése része az Európai Gyógyszerügynökség (EMA) azon erőfeszítéseinek, amelyek célja, hogy javítsák a betegek időben történő hozzáférését az új gyógyszerekhez”, hozzáférés 2017. szeptember 10 -én.
- ↑ Záró jelentés a kísérleti projekt adaptív útvonalainak kísérleti összefoglalójáról 2016. július 28 -tól, hozzáférhető 2017. szeptember 10 -én.
- ^ PV Bonanno és mtsai: Adaptív utak: lehetséges további lépések a fizetők számára a lehetséges megvalósításra való felkészülésben . In: Határok a farmakológiában . szalag 8 , 2017, doi : 10.3389 / fphar.2017.00497 , PMC 5572364 (ingyenes teljes szöveg).
- ↑ HG Eichler et al.: Gyógyszerek adaptív útvonalai a betegek számára: miért, mikor és hogyan vegyenek részt? In: Klinikai farmakológia és terápia . szalag 105 , nem. 5 , 2018, doi : 10.1002 / cpt.1121 , PMC 6585618 (ingyenes teljes szöveg).
- ^ Európai Gyógyszerügynökség: Hogyan gyorsítja fel az EMA a gyógyszerek és oltások fejlesztésének támogatását és jóváhagyását. Letöltve: 2020. június 12 .
- ↑ a b Európai Gyógyszerügynökség (EMA): Engedélyezési eljárások. Letöltve: 2020. június 12 .
- ^ FDA: Sürgősségi felhasználás engedélyezése. Letöltve: 2020. június 27 .
- ↑ Európai Gyógyszerügynökség a ritka betegségek gyógyszereiért (ritka betegségek gyógyszerei) . ( Memento 2017. január 31 -től az Internet Archívumban ).
- ↑ Jól bevált felhasználás az EMA szószedetében, hozzáférhető 2020. június 10-én.
- ↑ 2001/83 irányelv / EK európai parlamenti és tanácsi irányelv 2001. november 6-a közösségi kódexéről humán gyógyszerek közepén l cikkének 24.
- ↑ A 726/2004/EK rendelet 14. cikke.
- ↑ KE Lasser, PD Allen, SJ Woolhandler, DU Himmelstein, SM Wolfe, DH Bor: Az új fekete dobozra vonatkozó figyelmeztetések és a vényköteles gyógyszerek visszavonásának időzítése. In: JAMA . Kötet 287 (17), 2002, 2215-2220, PMID 11980521 .
- ^ DB Jefferys, D. Leakey, JA Lewis, S. Payne, MD Rawlins: Az Egyesült Királyságban engedélyezett új hatóanyagok 1972 és 1994 között. In: Br J Clin Pharmacol . 45. kötet (2), 1998, 151-156, PMID 9491828 .
- ↑ Jürgen Feick: Piacra jutás szabályozása: Nemzeti szabályozás, európai integráció és nemzetközi harmonizáció a gyógyszerek jóváhagyásában. In: Roland Czada, Susanne Lütz (szerk.): A piacok politikai alkotmánya. Westdeutscher Verlag, Wiesbaden 2000, ISBN 3-531-13415-9 , 228–249.
- ^ Jürgen Feick: Gyógyszerészeti forgalomba hozatali engedély az Európai Unióban. In: Csatlakozó európai szabályozók. Európai Politikai Fórum, London 2008, ISBN 978-1-903850-29-9 , 35-63.
- ↑ Reinhard Kurth: A Szövetségi Kábítószer- és Orvosi Eszközök Intézetének (BfArM) fejlődése a növekvő európai versennyel szemben. In: Szövetségi Egészségügyi Közlöny. 51. kötet (3), 2008, 340-344, PMID 18369569 .