Karbonsavak
| Karbonsavak |
|---|
|
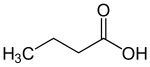
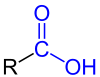
| Általános szerkezet a monokarbonsavak a karboxi funkciós jelölt kék . Az R gyök vagy hidrogénatomot vagy organilcsoportot jelent. |
Karbonsavak , más néven karbonsavak savak , olyan szerves vegyületek , amelyek hordoznak egy vagy több karboxicsoportot (-COOH), és így egy többé-kevésbé kifejezett savas jellegű. A sók A karbonsavak nevezzük karboxilátok . Azok a vegyületek, amelyekben a karboxilcsoport OH csoportját egy másik csoport helyettesíti, pl. B. -OR, -NH 2 vagy -Cl helyettesítjük, karbonsav-származékokat nevezzük. Az említett három példa szintén a karbonsavszármazékokhoz tartozik: karbonsavészterek , karbonsavamidok és karbonsavhalogenidek .
elnevezéstan
A karbonsavak szisztematikus elnevezéséhez németül az alapszerkezet nevéhez a "sav" szóösszetételt kell hozzáadni. Sok karbonsavnak szisztematikus neve is van (közönséges neve ), amelyek szintén „savval” végződnek. Az alkán bázikus felépítésű karbonsavakra példák a metánsav (hangyasav), etánsav (ecetsav) és butánsav (vajsav). A közönséges név a megfelelő karbonsavat többnyire tipikus előfordulás szerint azonosítja.
Osztályozás
Megkülönböztetünk alifás , aromás és heterociklusos karbonsavakat azon R csoport kémiai szerkezete alapján , amelyhez a –COOH csoport kapcsolódik . Az alifás karbonsavak tovább oszthatók alkánsavak , az alkén-karbonsavak és alkinsavanalógjait savak. Az alkánsavakat telített karbonsavaknak is nevezik . Az alkénsavakat, vagyis a maradékban legalább egy kettős kötéssel rendelkező karbonsavakat (például akrilsavat ) és a maradékban legalább egy hármas kötéssel rendelkező alkinosavakat telítetlen karbonsavaknak nevezzük .
Ezenkívül a karbonsavakat meg lehet különböztetni a bennük lévő karboxilcsoportok száma alapján. A monokarbonsavaknak egy karboxilcsoportjuk van, míg a dikarbonsavak (például oxálsav ) kettőt, a trikarbonsavak (például citromsav ) három karboxilcsoportot tartalmaznak.
Vannak még csoportok karbonsavak hordozó más funkciós csoportok mellett a karboxilcsoport, mint például a ketokarbonsavak , a hidroxi-karbonsavak (például tejsav ) és a aminosavak (valójában: aminokarbonsavak ).
A kémiai szerkezet szempontjából az úgynevezett zsírsavak nem képezik a karbonsavak speciális csoportját, mert ezek többnyire elágazó, alifás, telített vagy telítetlen monokarbonsavak, gyakran 12-től 22-ig, néha, mint a vajban , csak 4 szénatom mellett. Ott észterezik őket glicerinnel , úgynevezett trigliceridként állati és növényi zsírokban (lásd pl . Tejzsír ). Az újabb eredmények azt mutatják, hogy a rövid láncú és elágazó láncú karbonsavak is előfordulnak a zsíros lipidek a sejtmembránok, így ma minden karbonsavaknak (lánc-szerű) organil csoportokat lehet összefoglalni alatt a kifejezés zsírsav sav.
A karbonsavak előfordulásuk szerint azonosított másik csoportja a természetes gyantákban előforduló gyanta savak .
A kémiai szerkezet szempontjából az úgynevezett fémkarbonsavak nem tartoznak a karbonsavak csoportjába. Ezt a nevet adják azoknak a fém- komplexeknek a karboxi- ligandumokkal , amelyek köztes termékként fordulnak elő ( katalizált ) reakcióban szén-monoxiddal (CO) és szén-dioxiddal (CO 2 ), például a víz-gáz váltás reakcióban .
Példák
| alifás, telített monokarbonsavak |
ecetsav |
Vajsav ( zsírsav ) |
||
| alifás, telítetlen monokarbonsavak |
Akrilsav |
Olajsav ( zsírsav ) |
||
| alifás, telített dikarbonsavak |
Oxálsav | Borostyánkősav | ||
| alifás, telített trikarbonsavak |
Citromsav | Agarsav | ||
| alifás, telítetlen dikarbonsavak |
Fumársav | Maleinsav | ||
| aromás karbonsavak |
Benzoesav | Szalicil sav | ||
| heterociklusos karbonsavak |
Nikotinsav |
Pirrolidin-2-karbonsav ( aminosav ) |
||
| alifás, telítetlen, ciklikus monokarbonsavak |
Abietinsav ( gyantasav ) |
Gibberellinsav |
tulajdonságait
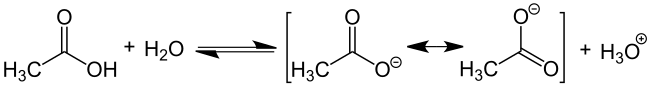
Az alkiláncban további funkciós csoportok nélküli karbonsavak kémiai tulajdonságait kizárólag a karboxicsoport határozza meg. A karbonilcsoport oxigénatomjának (C = O) viszonylag erős elektronelvonó hatása van, így a hidrogén és a hidroxilcsoport oxigénatomja közötti kötés erősen polarizált. Ez elősegíti a H + -ionok felszabadulását a karboxi-csoportból, amelyet itt ecetsav segítségével mutatunk be:
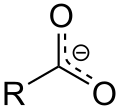
Ezenkívül a karbonsavak savas jellege a karboxilátanion mezomer stabilizálásának következménye . Kedvezi a karbonsav deprotonált formáját és ezáltal az anion stabilitását. Hasonló a mezomer stabilizálása benzol , a delokalizált elektron gyakran jelzi a következő jelöléseket (a példában, R jelentése metil-csoport CH 3 ).
A karbonsavak fizikai tulajdonságait (saverősség, forráspont vagy olvadáspont, vízben való oldhatóság) lényegében az alkilcsoport típusa és az alkilcsoportban jelenlévő szubsztituensek határozzák meg .
A karbonsav savassága kifejezettebb, annál rövidebb az alkillánc. Az alfa-szénatomon egy további szubsztituens , amely elektron-visszahúzódó induktív hatással rendelkezik (-I hatás), jelentősen növeli a sav erősségét. Egy pozitívabb részleges töltés kerül a karboxicsoportba , amely jobban ki tudja egyensúlyozni az anion negatív töltését és ezáltal stabilizálni az aniont. Erre példa a stabilabb triklór- acetát az acetáthoz képest . A karbonsav saverősségének egyik mérőszáma a sav disszociációs állandója vagy a pK s értéke
A rövid szénláncú, legfeljebb hat szénatomos karbonsavak színtelen, csípős ( hangyasav ) vagy kellemetlen ( vajsav ) szagú folyadékok, amelyek viszonylag magas forráspontúak. A karboxicsoport miatt a karbonsavak poláris jellegűek, ami jó oldékonyságot eredményez a vízben, amely az alkillánc hosszának növekedésével csökken. Két karboxicsoport megfelelő térbeli elrendezése elősegíti az intermolekuláris hidrogénkötések kialakulását, és így a karbonsav dimerhez vezet . A folyadék feletti gőztérben lévő részecskék dupla tömege megmagyarázhatja a karbonsavak viszonylag magas forráspontját.
A lánchossz növekedésével a karbonsavak lipofil jellege növekszik, a hidrofil karakter pedig csökken. Ez vonatkozik a karbonsavak sóira is . A lipofil alkil-lánc mellett, amelynek hatnál több szénatomja van, a sók hidrofil csoportot is tartalmaznak a karboxilátcsoporttal azonos molekulában. A hosszú láncú karbonsavak nátrium- és káliumsói tehát amfifil anyagok. Ezek a tulajdonságok a felületaktív és használnak túró szappanok és a lágy szappanok .
Gyártás
Oxidációk
Karbonsavakat csak elő a alkánok vagy aromás szénhidrogének helyettesített alkilcsoportok által oxidációs reakciók erős oxidálószerek , ha nincs más oxidálható funkciós csoportokat a molekulában, hogy lehet oxidált is, így például B. hidroxil- vagy amino-csoportok vagy CC kettős kötések, az alkilcsoportok teljes oxidációjának közbenső szakaszai az alkoholok és az aldehidek , amelyek ezért kiindulási anyagként is felhasználhatók az oxidációs reakciókhoz. Megfelelő oxidálószerek az oxigén , vagy akár az ózon , a kálium-permanganát , a króm-trioxid , a salétromsav vagy a kálium-dikromát .
- Alkánok oxidációja: Németországban 1930-tól kezdődően iparban alkalmazták az úgynevezett paraffin-oxidációt . Hosszabb láncú alkánok atmoszférikus oxigénnel és permanganátokkal való keverékét használtuk 120 ° C-on. kezelt. Az alkánláncok oxidatív hasítása különböző karbonsavak keverékét eredményezte, amelyeket el kellett választani. Melléktermékként alkoholokat és aldehideket állítottak elő. Az alábbi kapcsolódó reakcióegyenlet és az összes következő reakcióegyenlet sematikusan egyszerűsödik.
- Alkilezett aromás vegyületek oxidációja :
- Az olefinek oxidálása bázikus kálium-permanganáttal. Semleges körülmények között a reakció csak vicinális diolokhoz vezet .
Reakciók az alkillánc megnyúlásával
- Reakciója Grignard-vegyületek , előzetesen elkészített halogénalkánok , a szén-dioxid . Az ezt követő víz hozzáadása a szabad karbonsavhoz vezet. (A reakcióegyenlet mindkét lépést vázlatosan foglalja össze).
- Ha az alkiláncban vannak olyan funkcionális csoportok, amelyek megakadályozzák a Grignard-vegyület előállítását, akkor kitérőre van szükség
- a Kolbe nitril szintézisével és a nitril ezt követő hidrolízisével választható ki . (A reakcióegyenlet mindkét lépést csak vázlatosan foglalja össze)
Karbonsavszármazékok hidrolízise
- Az úgynevezett reaktív karbonsavszármazékok, pl. B. karbonsav-kloridoknak vagy -karbonsav-anhidrideknek nincs értelme, mivel a reaktív karbonsav-származékokat mindig karbonsavakból kell készíteni, hogy azokból más karbonsav -származékokat is képesek legyenek előállítani. Ez a hidrolízis reakció tehát többnyire nemkívánatos mellékreakció, amelyet kerülni kell reaktív karbonsavszármazékok alkalmazásakor.
- ,
- A karbonsav-észterek lúgos hidrolízise (" elszappanosítása ") vagy savkatalizált hidrolízise :
- A karboxamidok savas vagy bázikus hidrolízisét erős körülmények között kell végrehajtani, a karboxamidok stabilitása miatt.
- A nitrilek savas vagy bázikus hidrolízisének energetikai körülmények között is meg kell történnie a nitrilek stabilitása miatt.
Egyéb speciális reakciók
- Kolbe-Schmitt reakció : hidroxi-benzoesavak (pl. Szalicilsav ) szintéziséhez fenátokból és szén-dioxidból
- Benzilsav átrendeződés : az 1,2-diketonok α - hidroxi-karbonsavakká válnak
- Koch-reakció ( hidroformilezés ): az elágazó láncú alkének erősen elágazó szénláncú karbonsavakká válnak, ha szén-monoxidot adnak az α-szénatomhoz
Karbonsavak spektroszkópiája
A karbonsavak szerkezetének meghatározásához a legfontosabb analitikai módszerek az IR és az NMR spektroszkópia .
Az infravörös spektrumban a C = O nyújtási rezgés jellemzően 1710–1760 cm- 1 körüli , a széles OH nyújtó rezgés pedig 3000 cm –1 körüli jellemző.
Az 1 H-NMR-spektrum , a savas hidroxil-protonok tolódott a szokatlanul alacsony mezőt, 10-13 ppm. A karbonil-C alkilcsoportjainak protonjainak kémiai eltolódása körülbelül 2,0-2,5 ppm tartományban van; a közvetlenül a karbonilcsoporthoz kötött hangyasav-hidrogénatom 8,08 ppm-nél jelenik meg. A nem konjugált karbonsav szénláncában a csúcsok, amelyek távolabb vannak a karbonil funkciótól, egyre kevésbé erõsen elmozdulnak a mély mezõbe, mert a karbonilcsoport induktív hatásának hatása csökken.
A 13 C-NMR-spektrum , a karboxil szénatom található a tartományban mintegy 170 és 180 ppm.
Fontos reakciók
A karboxicsoport szénatomjával szomszédos két oxigénatom miatt, amelyek elektron-visszahúzó hatással bírnak, nukleofil támadások történhetnek a karboxicsoport szénatomján. A nukleofil támadást savkatalízissel (a karbonilcsoport protonálása) lehet elősegíteni, ha a támadó nukleofilek nem erős Brønsted bázisok , pl. B. Alkoholok. Amikor a nukleofilek bázisok, pl. B. ammónia vagy aminok a savkatalízissel protonálódnak és gyengülnek. Savkatalízis nélkül is az ilyen nukleofileket maga a karbonsav protonálja és hatástalanná válnak. Ugyanakkor a karbonsav megfelelő sói is képződnek, amelyeket már nem támadhatnak meg nukleofilek.
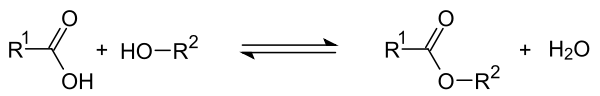
Esterifikáció
A savkatalizált észterezéssel , a karboxilcsoport egy szerves sav reakcióba lép a hidroxilcsoportot egy alkohol. Észter keletkezik, amikor a vizet szétválasztják . A reakció során fordított reakció lép fel, mert a keletkező észter karboxicsoportját a keletkező víz nukleofil módon is megtámadhatja. Az alkohol szétválasztása után az eredeti sav visszaképződik. Ha R 1 jelentése a maradék sav és R 2 jelentése a maradék alkohol, a következő egyensúlyi reakció lép fel az a reakció során :
Az egyensúly helyzete befolyásolható. Ha a képződött észter forráspontja alacsonyabb, mint a savé, folyamatos desztillációval nyerhető. Szilárd szárítószerek hozzáadása , amelyek megköthetik a vizet, lehetővé teszi az észterképzés teljesebb lefolytatását.
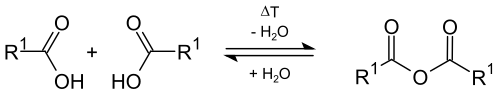
Kiszáradás
Elméletileg a karbonsavak könnyen átalakíthatók szerves karbonsav-anhidridekké a víz intermolekuláris eltávolításával ( dehidrációval ) magasabb hőmérsékleten . A laboratóriumi gyakorlatban ez a reakció ritkán sikerül, mert intramolekuláris dehidratáció magas hőmérsékleten is előfordulhat, ketének képződésével.
A karbonsav-anhidridek karbonsavakból történő képződésének alternatívája az erősen dehidratáló anyagok ( foszfor-pentoxid ) hozzáadása vagy egyéb reakciók, például a karbonsav-halogenidek reakciója a karbonsavak sóival, vagy a ketének reakciója a karbonsavakkal .
A karbonsav-anhidridek vízzel reagálhatnak a megfelelő karbonsavakra.
web Linkek
Egyéni bizonyíték
- ↑ karbonsav a Duden.de webhelyen, hozzáférés: 2016. január 15
- ↑ karbonsav a Duden.de webhelyen, hozzáférés: 2016. január 15
- ↑ a b Brockhaus ABC kémia. VEB F. A. Brockhaus Verlag, Lipcse 1965, 645-646.
- ↑ G. Wietzel: gyártása szintetikus zsírsavak oxidációjával paraffinos szénhidrogének molekuláris oxigénnel. In: Vegyészmérnöki tudomány. 3, 1954, 17-IN4. O., Doi : 10.1016 / S0009-2509 (54) 80003-0 .